|
|
|
|
|
|
|
�ĤG���G�V�y�P
²��
���P�R�ʸV�y�P�A�Y�j�ɺ٬��u�V���E�̡v(Fowl Plague)�A�O�����z�L����(�p����)�����ҶǼ����ǬV�f�C���b1878�~�N�j�Q(Perroncito
1878)�w�X�{�C����@���Q�~�H���O�N�j�Q�W�Y��(upper Po valley)���ۤک��f�g(Lombardian
disease)�C���M�b1901�~Centanni �M Savonuzzi�w���{���O�Ѥ@�عL�o�ʯf�r�ҾɭP�A���̫��1955�~�~��Schäfer���D�O�Ѥ@�إs�y��ʷP�_�үf�r(influenza
A viruses)�ҷP�V�C���A�y��ʷP�_�үf�r(influenza A viruses)����ݳ��ͳ����H�D(�p���ͤ���)�ӻ��A�@�뤣�|�X�{����x�������A�]�����f�r����Ǧ]�l�ݧC�P�R���A��P��H�D�F�ܥ��Ŧ@��(Webster
1992, Alexander 2000)�C
�o�ǧC�P�R�ʸV�y�P�f�r(LPAIV)�q���ͳ������W�Ǧܨ�a�V����(�p�����Τ�����)�A�ӳo�ӹL�{�٬��u��e�P�V�v�C�ѩ�@��a�V�����ܷP�V��O���z�A�G�i��|�X�{�@�ǻ��L���P�V�x���C�f�r�p�G�b�a�V�餺�g�L�h���ϴ_�P�V��A���F�A���s�رH�D�A�f�r�����|�X�{��]�ܺءC�Ӭy��ʷP�_�үf�r���ƿ�Ǧ]�lH5��H7���ܲ��A���F�A���s�رH�D�~�A�]�[�t�F�������P�R�ʸV�y�P�f�r(HPAIV)�C�ƹ�W�A�ѧC�P�R�ʸV�y�P�f�r(LPAIV)
���ƿ�Ǧ]�lH5��H7�b�a�V�������W�A�ܺئ����P�R�ʸV�y�P�f�r(HPAIV)�O���H�w�����C
���P�R�ʸV�y�P�f�r(HPAIV)�b�a�V�餺�A���{�O��o�ʡB�u�ɶ����ް_�Y���e�f�ι������P�V����������G�ʤ��ʦ��`�v�C�ѩP�R�ʸV�y�P(HPAI)�|�y���a�V�~���j�g�ٷl���A�G��s���Ĺ�ܰ��P�R�ʸV�y�P(HPAI)���̭]�A�w�����~��ɩΥ��y�����`���@�Ӱ��D�C�A�̡A���P�R�ʸV�y�P(HPAI)�O�ѩ�C�P�R�ʸV�y�P�f�r(LPAIV)���ܺءA�G���ɭP�C�P�R�ʸV�y�P�f�r(LPAIV)�P�V���ƿ�Ǧ]�lH5��H7��������`
(OIE
2005)�C���n�A�b1997�~���e�A�u�ݩu���e�f�A����1950�~�}�l�A���y�Ȧ�24�v���P�R�ʸV�y�P�P�V�ӮסC
�̪�A�V�y�P�A���������y�����`�A��]�O1997�~���b�n����a�ϥX�{���P�R�ʸV�y�P�f�r-H5N1�A�Ϋ��ǦܪF�n�Ȥ@�a�C�ѩ�����X�{�f�r�ѸV�����Ǧܭ�����(�p�ߡB�ޤΤH��)�A�G���ҿ��u�����ǬV���١v(traversed
interclass barriers)�ĥΡA�{�b�w���H�֩w(Perkins
and Swayne 2003)�C���M�A�V�y�P���O�@��ūe�������ƥ�(Koopmans
2004�BHayden�� Croisier 2005)�A���o�X�v�H�����P�V�Ӯת��X�{�A���藍��ư�H5N1�f�r�|��H���i��y���Y���e�f�έP�R�¯�(Klempner��Shapiro
2004�F Webster
2006)�C�t�~�A���֬�Ǯa�}�l�M��u������H5N1�f�r�O�_�����|��������y���P�R�¯١C���L�A�i�H�֩wH5N1�f�r�w�������y�H�������`�����D(Kaye
and Pringle 2005)�C
���@. �L�h���@�ɪ����P�f�ʸV�y�P�z�o1
|
�~��
|
��a/�a��
|
���v�T�a�V
|
�~��
|
|
1959
|
Ĭ���� |
��2�s(�w���G) |
A/chicken/Scotland/59
(H5N1) |
|
1963
|
�^�� |
�����دb29,000�� |
A/turkey/England/63
(H7N3) |
|
1966
|
�w�j��
(�[���j) |
�����دb8,100�� |
A/turkey/Ontario/7732/66
(H5N9) |
|
1976
|
���h�Q��
(�D�w) |
�J��25,000���A����17,000���A�n16,000�� |
A/chicken/Victoria/76
(H7N7) |
|
1979
|
�w�� |
�֦�600,000�����@�s���A�Z80�� |
A/chicken/Germany/79
(H7N7) |
|
1979
|
�^�� |
�����ӷ~�A��3��
(�S�����G�����`��) |
A/turkey/England/199/79
(H7N7) |
|
1983-
1985
|
���i�k���Ȧ{
(����)* |
452�s�����@�d�C�ʸU�����F�j�����O�����Z�A�ֶq���l�ί]�� |
A/chicken/Pennsylvania/1370/83
(H5N2) |
|
1983
|
�R���� |
�פ���800�����`�F��֤F����8,640���A��28,020���A�n270,000�� |
A/turkey/Ireland/1378/83
(H5N8) |
|
1985
|
���h�Q��
(�D�w) |
�����دb24,000���A�J��27,000���A����69,000���A�S���T�����~�ت���118,478�� |
A/chicken/Victoria/85
(H7N7) |
|
1991
|
�^�� |
����8,000�� |
A/turkey/England/50-92/91
(H5N1) |
|
1992
|
���h�Q��
(�D�w) |
�����دb12,700���A�n5,700�� |
A/chicken/Victoria/1/92
(H7N3) |
|
1994
|
���h��
(�D�w) |
�J��22,000�� |
A/chicken/Queensland/667-6/94
(H7N3) |
|
1994-1995
|
�����* |
�����`�Ƥ��ԡA��֤F�a�V�ƥت��ӷ~���s360�� |
A/chicken/Puebla/8623-607/94
(H5N2) |
|
1994
|
�ڰZ* |
�����Φ����دb�T�ʤG�Q�U��
|
A/chicken/Pakistan/447/95
(H7N3) |
|
1997
|
����
(����) |
���@�ʥ|�Q�U���Τ�e�̼ƥؤ֪���L�U�خa�V |
A/chicken/Hong
Kong/220/97 (H5N1) |
|
1997
|
�s�n�º��h
(�D�w) |
�����دb128,000���A����33,000���A������261�� |
A/chicken/New
South Wales/1651/97 (H7N4) |
|
1997
|
�N�j�Q |
���B�����B�]���B�n�B�O�L�B�F�B�Z�B������6,000�� |
A/chicken/Italy/330/97
(H5N2) |
|
1999-
2000
|
�N�j�Q* |
413�ӹA���A���@�d�|�ʸU������ |
A/turkey/Italy/99
(H7N1) |
|
2002-
2005
|
�F�n��* |
����B����B�L���B�饻�B�Z
�H��B�Ѿ�B���Ӧ�ȡB����B����B�V�n�A���@�����d�U������ |
A/chicken/East
Asia/2003-2005 (H5N1) |
|
2002
|
���Q |
|
A/chicken/Chile/2002
(H7N3) |
|
2003
|
����* |
�����G�A��255�ӡA�T�d�U�������F��Q�ɡG�A��8�ӡA�T�ʸU�������F�w��G�A��1�ӡA����80,000�� |
A/chicken/Netherlands/2003
(H7N7) |
|
2004
|
�[���j
(���֬�)* |
�V�s53�ӡA���@�d�C�ʸU�� |
A/chicken/Canada-BC/
2004 (H7N3) |
|
2004
|
����
(�w�{) |
����6,600�� |
A/chicken/USA-TX/2004
(H5N2) |
|
2004
|
�n�D |
������23,700���A��5,000�� |
A/ostrich/S.Africa/2004
(H5N2) |
1�ק�� Capua and Mutinelli, 2001
*��\�h�A�������j�Ǽ����z�o�A�ޭP�j�q�g�ٷl���C�j������l���z�o�u�O���Y����H�A���������εL�Ǽ��C
�f�r
�y��ʷP�_�f�r�O�y���α������ɤl�A�]�q�ӹF�ܤK�Ӹ`�q���t������ֿ}�ֻ�(ss-RNA)
��]�աC���֦����H�G�f�r�� (Orthomyxoviridae family) ����ǩʽ�A�îھڨ�ֳJ�դΰ��J�ժ��ܭ�t���Ӥ����ҡB�A�Τ����C�V�y�P�f�r(AIV)�ݩ�ҫ��C����y�P�f�r�����c�νƻs�N�A�̪�N���X�⪺��X���ץX��
(�Ҧp Sidoronko and Reichl 2005)�C
�ҫ��M�A���y�P�f�r���D�n�ܭ�M�w�]���N�O�微�� (haemagglutinin, H
or HA)�ί��g�i�ĞJ (neuraminidase, N or NA) �o��ج、�}�J�աC���̯�ް_�S�w�ȫ��ΧK�̤����A�b
�P�@�ȫ����㦳�������O�@�@�ΡA���b��ȫ������p�U�u�������O�@�@�ΡC�ھڳo�ǿ}�J�ժ��ܭ�ʡA�ҫ��y�P�f�r�@��E����16��H�ȫ�
(H1 - H16) �� 9��N�ȫ� (N1 - N9)�C�o�Ƕ��s�O���O�b���R�بt HA��NA��]���֥̻ĤΤw���ת����ħǦC���ҹꪺ�C
���y�P�f�r�������A�D�Ϊ��R�W�k�n�D�]�t��f�r���O�B�J�D (���H�H�����_���ɬٲ�)�B�a�ϡB�Ǹ��Τ����~���C�ܩ�ҫ��y�P�f�r�A�|�H�A���[�W��微���ί��g�i�ĞJ���ȫ��C�{�b�z�o��H5N1�Ȭw�@�t���䤤�@�ӿ˥N�~�ءA�O�����ۤ��ꪺ�@�Ӭ�
(�s�F) ���@���Z �A�����a�A���Q�w�W��A/�Z/�s�F/1/96 A/goose/Guangdong/1/96
(H5N1) (Xu 1999)�C�Ӥ����ۭ��䪺�Ĥ@�ӤH���P�VH5N1�Ȭw�@�t�Ӯת� (Claas
1998) �h�Q�k���� A/HK/156/97 (H5N1)�C
�微���O�O�b�f�r�]���W�A��562 - 566�Ӯ��Ĵݰ�զ����}��Ƥ� �ƳJ�աC�佤��
�ݪ��y�Υ~�����c�쪺�y���e�ݡA�P���ݱa���g�i�ĭl�ͪ�����}�զ����ӭM���鵲�X (Watowich
1994)�C���g�i�ĞJ�A�Y�ĤG�Ӭ、�}�J�ե~���c��A�|�I�[��G�ĸўJ����������b�X�ޮɱq���P�V�ӭM�������f�r�l�N�C�o�\���קK�F�X�ޮɪ��f�r�E���A�γ\�ٷ|�P�i�f�r�q�L�ؼФW�ֲ�´�H���i��}���A�ޭP�f�r����
(Matrosovich
2004a)�C�o�ϯ��g�i�ĞJ�����ȱo�������ܯf�r�ؼ� (Garman
and Laver 2004)�C�f�r�~�ت���ܩʿ}�J��HA�MNA���ۤ���լ��ʡA��f�r�ɤl�����Ī��ۤ�����L�{�A�O���n��
(Wagner 2002)�C �ƳJ�աC�佤��
�ݪ��y�Υ~�����c�쪺�y���e�ݡA�P���ݱa���g�i�ĭl�ͪ�����}�զ����ӭM���鵲�X (Watowich
1994)�C���g�i�ĞJ�A�Y�ĤG�Ӭ、�}�J�ե~���c��A�|�I�[��G�ĸўJ����������b�X�ޮɱq���P�V�ӭM�������f�r�l�N�C�o�\���קK�F�X�ޮɪ��f�r�E���A�γ\�ٷ|�P�i�f�r�q�L�ؼФW�ֲ�´�H���i��}���A�ޭP�f�r����
(Matrosovich
2004a)�C�o�ϯ��g�i�ĞJ�����ȱo�������ܯf�r�ؼ� (Garman
and Laver 2004)�C�f�r�~�ت���ܩʿ}�J��HA�MNA���ۤ���լ��ʡA��f�r�ɤl�����Ī��ۤ�����L�{�A�O���n��
(Wagner 2002)�C
�ҫ��y�P�f�r�ɤl�ܲӭM�����J�ս誺�pô�i�g�Ѧ����T�E�ƪ��f�rHA�}�J�չF���C�pô�i�H���h���ѧO���T�����ݳ�G�ĺ���
(N-acetyl- or N-glycolylneuraminic acid)�A�s���ܥb�ſ}���t�}�����
(�\2-3 or �\2-6)�A�H�Φb�ӭM������G�Ĺ�}��`�h���������� (Herrler
1995, Gambaryan 2005)�C���P��G�Ĺ�}���h�ˤƪ����F������Ӧۤ��P�y�P�f�r�J�D����´�M�����C�f�r��HA��NA�}�J�աA��̹�Y�J�D�ت��S�w����������A���ʡA�O���IJv�ƻs�����n����(Ito
1999, Banks 2001, Matrosovich
1999+2001, Suzuki
2000, Gambaryan 2004)�C�o�t�ܤFHA�J�ժ����鵲�X���̷Ӻض��P�V������
(Gambaryan 2006)�C�Ϥ@��ܤF�h�˪���������������`�סC�V�y�P�f�r���M��ܥX��\2-3�s������G�Ħ��̰����˦X�ʡA�]���o�O�X�۳Q�o�دf�r��w�����������ְ_��
(�z�A��) ���W�ֲ�´���D�n������� (Gambaryan 2005a, Kim 2005)�C�ۤϡA�A���H�����y�P�f�r�A�h����������F�H����D�D�֤�ӭM���j�h�ƪ�2-6�s���ݰ�C�o�ب���ߦn�����F���ݫ̻٪��@�����A�קK�V���f�r��H���L��ê�ǬV
(Suzuki
2000, Suzuki 2005)�C���̪�A�w�ҹ�F�H����ޤ����@�w�ƥت��֤�ӭM�P�˱a�����C�K�סB���V�����骺�}��X��
(Matrosovitch 2004b)�A�����ӭM��a���C�@�P�H�P�ت���G�Ĩ��� (Kim
2005)�C�o�γ\����H����Ӧ۬Y�ǸV���~�ت��P�V����ܤO�ä��O��������] (Beare
and Webster 1991)�C�ޡA�٦��O�L�A��֦̾��������K�ת���������A�ϳo�ǫ~�إi�H��V���ΤH�����w�V�X�e��
(Kida 1994, Ito
1998, Scholtissek 1998, Peiris
2001, Perez
2003, Wan and Perez 2005)�C
���f�r�ɤl���\�s����A��������A����J�ը̿�Τ��̿����|��o�ǯf�r�ɤl�b����ϫǤ��b��
(Rust 2004)�C�f�r���P���齤�ĦX�A�ϯf�r�קK�F�b�o�ϫǤ������ѡC�q�L�B���pH5���֤��骺�f�r���-2
(M2) �q�D�J�ժ���l�B�鶡���P�i�A���-1 (M1) �J�դΦP���T�E��HA�}�J�սƦX�����@�s�ꪺ�Ŷ����Ư��p�K�|�}�l�C���G�A�C��HA��ɪ����˯שʿĦX���c��|���S�X�ӡA�O�J���齤���A�q�Ӥް_�f�r���η��J�齤���ĦX
(Haque 2005, Wagner
2005)�C
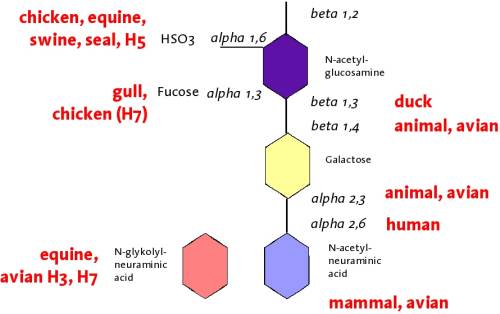
�Ϥ@. �ҫ��y�P�f�r���鰾�n���n (�ƾڰ�� Gambaryan
2005)
���Ӧb�֦�߳J�� (�ֿ}�ֳJ�սƦX��Aribonucleoprotein
complex�ARNP) �O�@�h�����K�ӯf�r��]�ծֿ}�ֻĤ��` (genomic RNA
segments) �|�Q�����ӭM��C�b���̡A���̷|�Q�ǰe�ܲӭM�֧@�f�r�@�H��RNA����M��]��RNA�ƻs�C�o�ӽ������L�{�ѯf�r�βӭM�]�l�L���a����
(Whittaker 1996)�CRNA�̿�RNA�E�X�J(RNA-dependent RNA
polymerase�ARdRp) �O�ѯf�rPB1�APB2��PA�J�ժ��ƦX��զ��A�ӳo���u�@�O�ݭn�]��RNA
(RNPs)�C�b�f�r�J�ժ���Ķ�����Ӥw�ƻs����]��RNA�֦�ߪ����X����A�l�N�f�r�ɤl�q�ӭM���o�ަܯf�r�}�J�դ��e�O�J���B�C���۪��֦�ߤίf�r�]���J�ն����ƦC�O�ѧΦ��f�r�]���U�ߪ����c���f�r���-1
(M1) �J�ձ���C�b�����\�i���ӭM���A�Y�z�Q����]�s�s�b�A�f�r�c�ެO�@�ӧֳt (�֩�Q�p��)
��IJv���B�J (Rott 1979, Neumann 2004)�C
�q�y�P�f�r���[��i�H�ݥX�A�ѩ�f�rRdRp�����t���ʡA�C�Ӯ֥̻ĨC���ƻs�g���|���ͦh��5x10-5�Ӯ֥̻����ܪ����ܲ��v�A�H�P�C�Ӱ�]�ըC���ƻs�����t���h����@�Ӯ֥̻�����
(Drake
1993)�C���Ͽ�ܩ����O (�p���M����A���z�Q���鵲�X�A�Τƾǧܯf�r��) �b�f�r�ƻs�ɥH�J�D�αڸs�{�ק@�Τ��A��������ܩ��u�ժ�������
(�p�k�פ��M�A������鵲�X���) �i��|�Q�X�Ӧ������J�D�αڸs�f�r�Ǻت��������C�p���}�J��HA��NA���ܭ�M�w�]�����K�̤O����v�T�A��
(�v�B��) �L�{�k�@�ܭ��Ʋ� (Fergusson 2003)�C
�ۤϡA�ܭ�첾�O���ܭ�M�w�]������M�Χ������ܡA�p�b�P�@�ƻs�g����H�M/��N���ȫ����ܡC�o�o�ͩ�P�ɳQ��ةΥH�W���P�ȫ����ҫ��y�P�f�r�P�V���ӭM�C�]���w�ƻs��]�դ��`��o�ޤ����f�r�l�N�����G�P�C���`���ȫ��_���O�W�ߵo�ͪ��A�i��|�X�{�a�����P�f�r�˥N��ǫH�������ƻs��O���l�N
(�ҿת����t��) (Webster andHulse 2004, WHO
2005)�C���M1957�~��1968�~�y�檺�H���y�P�f�r (���O�OH2N2�MH3N2)
��M�O�ѤH���θV���f�r�����t�έ��s�ƦC�զX�Ӳ��͡A1918�~�ް_�u��Z���y�P�v���y�P�f�r���G�O�����l�ͦ۸V��
(Belshe 2005)�C
�ѵM�J�D
���ͤ����A�ר�O���Υ� (�n�B�Z) �� �Υ�(���áB�س�)
�������A�O�ҫ��y�P�f�r�����ȫ��������a�ߪ̡A�ҥH�̦��i��c�������ҫ��y�P�f�r���ѵM�x�w
(Webster 1992, Fouchier 2003, Krauss 2004, Widjaja
2004)�C�۫H�Ҧ������~�س��O�����v�T�A���@�Ǯa�V�A�p���B�����B�]���B�O�L�B�����A�O�w���S�O����m��P�V�����g���C �Υ�(���áB�س�)
�������A�O�ҫ��y�P�f�r�����ȫ��������a�ߪ̡A�ҥH�̦��i��c�������ҫ��y�P�f�r���ѵM�x�w
(Webster 1992, Fouchier 2003, Krauss 2004, Widjaja
2004)�C�۫H�Ҧ������~�س��O�����v�T�A���@�Ǯa�V�A�p���B�����B�]���B�O�L�B�����A�O�w���S�O����m��P�V�����g���C
�ҫ��y�P�f�r���M���|�ϤѵM�J�D�ͯf�C�ϦӡA���̷|�O���i���R��A�Q�H�x�²b�i�ƪ��C(N/S���)�D�P�����W/�P�����W�ܲ���ҧ@���l�H���q��
(Gorman 1992, Taubenberger 2005)�C�J�D�P�f�r���G�H�@�ӷ��ӽo���Ū��ۤ��ԭ@���A�s�b�A�o�O�q�{�ɥH�ʥF�e�f�ΰ��IJv�f�r�ƻs�o�H�ҩ��C�T�K�i�H�ƥX�j�q���f�r,�����C�J�t�۷���108.7
�V�F�b�ƷP�V�q (EID50) (Webster
1978)�C���o�ǯf�f�Ǽ��찪������m���a�V�~�ءA�q�`�|���ͻ��L���f�x�A�Y�����ܡC�o�@�������f�r�O�ݩ�C�P�f��
(LPAIV)�A�Ӥ@��u�|��ͳJ�V�b���J���q�ɭP���L�εu�ȤU���δ�֥��Q�i�Ϊ��V�b�����q�W��
(Capua and Mutinelli 2001)�C�M�ӡA�b�ǬV�ξA���s�a�V�J�D��AH5��H7���ȫ��~�ئ���b���i��|���ܦ����P�f�������C�b���ͳ������q�S�[��o��H5�BH7�Ψ�L�ȫ������P�f���_��
(Webster 1998)�C�ҥH�A�����P�f����i�Q�����H�����A�u�|�O�H����۵M���Ū��t�Χ@�X�z�w�����G�C
�����P�f���f�r�������b�a�V���X�{�A���̥i�H�Ѯa�V�����Ǽ��^���ͳ����s�C���ͳ����ﰪ�P�f���f�r�ް_���e�f������m�ʡA�̷Ө�����B�~�֡B�f�r�بӬݡA�ܤƫD�`�j�C���P�f���f�r�u�O�ӧO�a���X�쳥�ͳ����s�A�ӥB�u������a
(1961�~�n�D�P�ì��~���h�u�ݭӧO�Ҥl [Becker 1966])�A�]���S�������ͳ����q�����y��f�Ǫ����n�@�ΨӶǼ����P�f���f�r�A���ܨȬw�@�t��H5N1���P�f���f�r���X�{
(Swayne and Suarez 2000)�C�۱q2005�~�����A�b�����_�����C����۵M�O�@�Ϫ����ͤ������A�[��XH5N1���������P�f���Ȭw�@�t���j�z�o
(Chen 2005, Liu 2005)�A�o���p�i��w�b�ڥ��a���ܡC�]���A�b2005�~�i�H�o�{�o�f�r�V�ڬw���i�@�B�Ǽ�
(OIE
2005)�C�o�@�L�{���Ա��ε��G�p�U:
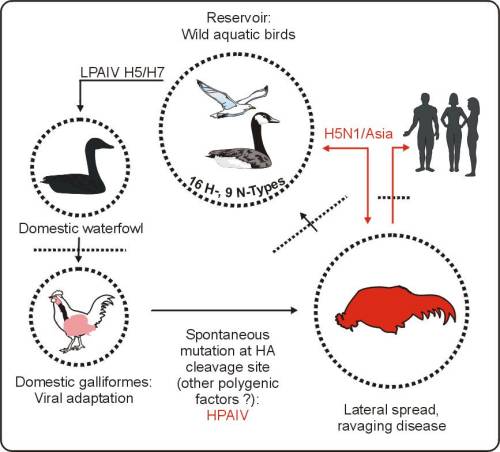
�ϤG. �V�y�P�o�f�άy��f�ǺK�n
LPAIV �w �C�P�f�ʸV�y�P�f�r; HPAIV �w ���P�f�ʸV�y�P�f�r;
HA �w �微���J��; ���b�Y����u���ܺ��ݫ̻�
���P�f�ʬy�P���o�f
�ҫ��y�P�f�r�����M�S�� �w �P�f�ʡA�O�@�Ӧh��]�ʪ��A�ӥB�b���h��]�s�����A�j�q�a�̾a�|�v�T�J�D�β�´�ͦV�ʡB�ƻs�ĤO�ΧK�̰k����z�Q��]�s���]���C�t�~�g�L�ض��ǬV�A�S�w���J�D�Ϊ��ئ]���P���P�V�A�N�ɭP�@�}�l���i�w�ƪ����G�C�V�y�P�f�r�����P�f���u���l��ҫ��y�PH5��H7�ȫ��C�M�ӡA�u���ּ�H5��H7�ȫ��e�{�X���P�f���ͪ���
(Swayne and Suarez 2000)�C�q�`�AH5��H7�f�r�b�ѵM�J�D���w�w�a�O���C�P�f���C�f�r��q�o�x�w���z�L���P�~�|
(���U) �ǤJ�a�V�s���C�f�r�b�����v�T���a�V�ڸs�A�u�ӥi�ܤΤ����T���`���ɴ��A�j���٦��A���A������D���ܦ����P�f��
(Rohm 1995)�C
�֥̻ħǦC���w�ҩ��F�j�������P�f�ʸV�y�P�f�r��HA��]���@�P���S�x�A����@���a�V���r�ʼаO
(Webster 1992, Senne 1996, Perdue 1997, Steinhauer
1999, Perdue and Suarez 2000)�C
���F�o��P�V�O�A�ҫ��y�P�f�r�ɤl�ݭn�N��HA0���X��g���J�ճB�z���G������HA1,2�G�E����HA�J�ղV�X
(Chen 1998)�CHA2�ȳ��s�y�����ݥ]�Ӥ@�ӥѿ˯שʵ��c��զ����ĦX (Skehel
2001)�C�f�r���η����齤���ĦX�L�{���ݭn�o�ӵ��c��A�]�����|�o�f�r��]�դ��`�I�J�J�D�ӭM�誺�L�{�C�C�P�f���f�r��HA�Ť����I�Ѧ�m
-1/-4 (H5) �� -1/-3 (H7) ����Ӯ��IJզ� (Wood 1993)�C�o�Ǧ��I�i�H���S�O���w�b�I�l�θz�G�W�֪������F���S�w��´�سJ�կ몺�J�կ�i�J�C�]���A�̤֬O�b�ѵM�J�D���A�C�P�f�ʸV�y�P�f�r�����IJv�ƻs�۫H�O�j�j�a������o�Ǧ��I�C�ۤϡA���P�f�ʸV�y�P�f�r���Ť����I�@��t���B�~���P�ʮ���
(���ĩM/�ο���)�A�ϱo���I��B�z��-R-X-K/R-R-�̤p�@���ǦC�S�w��subtilysin�뤺�J�՞J(Horimoto
1994, Rott 1995)�C�o���J�՞J (�p���L�J�՞J�A�J�՞J��ƞJ) ���D��t���h�M�G���骺�C�Ӳ�´�C�]���A�a���o�Ǭ��ܪ��f�r�֦����t�Φa��������a�ƻs���u�աC�o�L�{�w�b�o��쪺�ƭӳ��X���Ҿ��ҩ��C�Ҧp�b�N�j�Q�A�H�e�b�����������s���Ǽ��F�Ƥ몺�C�P�f�ʸV�y�PH7N1�f�r�A�b1999�~12��A���P�f��H7N1�V�y�P�f�r�X�{�Τް_�F�����ʪ��e�f�A�ӥu��q�o�f�r���h�P�Ť����I�⥦�Ψ���X�̤���X��
(Capua 2000)�C (Skehel
2001)�C�f�r���η����齤���ĦX�L�{���ݭn�o�ӵ��c��A�]�����|�o�f�r��]�դ��`�I�J�J�D�ӭM�誺�L�{�C�C�P�f���f�r��HA�Ť����I�Ѧ�m
-1/-4 (H5) �� -1/-3 (H7) ����Ӯ��IJզ� (Wood 1993)�C�o�Ǧ��I�i�H���S�O���w�b�I�l�θz�G�W�֪������F���S�w��´�سJ�կ몺�J�կ�i�J�C�]���A�̤֬O�b�ѵM�J�D���A�C�P�f�ʸV�y�P�f�r�����IJv�ƻs�۫H�O�j�j�a������o�Ǧ��I�C�ۤϡA���P�f�ʸV�y�P�f�r���Ť����I�@��t���B�~���P�ʮ���
(���ĩM/�ο���)�A�ϱo���I��B�z��-R-X-K/R-R-�̤p�@���ǦC�S�w��subtilysin�뤺�J�՞J(Horimoto
1994, Rott 1995)�C�o���J�՞J (�p���L�J�՞J�A�J�՞J��ƞJ) ���D��t���h�M�G���骺�C�Ӳ�´�C�]���A�a���o�Ǭ��ܪ��f�r�֦����t�Φa��������a�ƻs���u�աC�o�L�{�w�b�o��쪺�ƭӳ��X���Ҿ��ҩ��C�Ҧp�b�N�j�Q�A�H�e�b�����������s���Ǽ��F�Ƥ몺�C�P�f�ʸV�y�PH7N1�f�r�A�b1999�~12��A���P�f��H7N1�V�y�P�f�r�X�{�Τް_�F�����ʪ��e�f�A�ӥu��q�o�f�r���h�P�Ť����I�⥦�Ψ���X�̤���X��
(Capua 2000)�C
�w����������H5��H7�ȫ���HA��]�]���@�W�S��RNA�G�ŵ��c�A�H�b�ѽX�@HA�J�ժ����J�հŤ����I���h�I��ǦC�d�f�r�E�X�J��쪺�A�ƻs����A���U�J����
(�K�X�ƻs) (Garcia 1996, Perdue 1997)�C�o����A�j���٦���L�p�֥̻Ĵ��N�Τ��q�����ժ�����
(Suarez
2004, Pasick 2005)�A�η|�ޭP�P�ʮ��Ĵݰ��X�C��̤w�g�ѹ���A�u�өw����ܧΦ����Ƴq�L�餺�~�A�ϧC�P�f�ʸV�y�P�f�r���X�̲��Ͱ��P�f�ʸV�y�P�f�r���ҩ�
(Li
1990, Walker and Kawaoka 1993, Horimoto
and Kawaoka 1995, Ito
2001)�C�ۤϦa�A�ΤϦV��Ǿǰ��h�h�P�Ť����I�|��ְ��P�f�ʸV�y�P���� (Tian
2005)�C
�i�O�A�f�r��:�ѽX�@HA�Ť����I���֥̻ħǦC�P�w��������/�P�f�����P,�Ѥ��q�����էΦ������Q�HH7N3���P�f�ʸV�y�P�f�r�u�b��m-1,
-4��-6���{�P�ʮ��� (Suarez 2004)�CH5�@�t�s�b�ӥi�H������Ҥl (Kawaoka
1984)�C�ۤϡA����w�{�@H5N2�j�����ҹꤺ�t���P�f�ʸV�y�P�f�r�Ť����I���@�P�ǦC�A���Q�{�ɤ������C�P�f�ʸV�y�P
(Lee 2005)�C�o�Ǹ�ƦA���j�ոV�y�P�f�r�P�f�ʪ��h��]�ο���������ʽ�C
���B�a�A�b�г��_�������P�f�ʸV�y�P�������G�u���C�b�L�h���Q�~�A�Ѱ��P�f�ʸV�y�P�f�r�o�����P�f�ʸV�y�P�z�o(������)�u��24�v�A�ܥi�୫�s�X�{�b�г��W�C�o�w�b���y�s�x���ɡC
(���@)
���~�A�w�ҹ갪�P�f�ʸV�y�P�f�r����P�V�������ʪ��A�S�O�O�H���C�o�w�Q�M���a��H5N1�Ȭw�@�t�w�g�[���(WHO
2006)�C���P�f�ʸV�y�P�f�rH5N1��������ʪ����̿�J�D�P�f�ʤw�b�ƭӺ��ݼҫ�����s:
�ѹ� (Lu
1999, Li 2005a) �A ���I (Zitzow
2002, Govorkova 2005) �A cynomolgous�U�l (Rimmelzwaan
2001) �M�� (Choi 2005)�C�P�V�����G���M��f�r�����αJ�D���ݡC���I���G���ѹ����H���P�f�ʤϬM���n(Maines
2005)�C
�@�Ǭ۫H�O�o�A�o�f����ǼаO������H5N1��Z��]�������P���` (���G)�C�䤤�A�z�LNS-1��]�����z�w�J�D���ѧK�̾������A�p�z�Z���t�ΡA������㪺���`�C����W�A
�w�ΤϦV��Ǿ��ҩ��@��H5N1�~�ئb��m92�W�a������Ī���NS-1�J�կ������z�Z���θ~�F�a���]�l�\���ܯf�r�@�εo�͡A�̲פޭP���P�V�J�D�����ƻs�W�j�δ�ֱq�J�D���M��(Seo
2002+2004)�C�t�~�ANS-1����ӭM�]�l�����������ͪ��K�̱���ˮ`�γ\��������ͳ��l�`
(Cheung 2002,
Lipatov 2005)�C�M�ӡA�S���@�Ӭ��� (���G) ��W�ߦa�H�x�������ʪ������P�f�ʪ��u�����n����
(Lipatov
2003)�C�]���A�b�������ʪ��A�z�Q��]�s�ݨӸ��j�{�פW�H�̿�J�D���覡���ϥX�P�f���S��
(Lipatov
2004)�C
���G. �ҹ�P���P�f�ʨȬw�@�tH5N1�f�r�����������ʪ��P�f�ʦ�������]���I���n
|
��]�A �J��
|
����
|
�v�T
|
�Ѧ�
|
| HA |
�h�P�Ť����I |
�t�Ωʴ����νƻs�u�� (�a�V�A������) |
���h |
| NA |
������19-25�� ���ħR�� |
�A���b���Τ��������ͪ�(?) |
Matrosovich
1999, Giannecchini 2006 |
| PB2 |
627K
701N
|
�b�����W�[�t�Ωʽƻs
�b���������P�f�� |
Hatta 2001, Shinya
2004
Li 2005 |
| PB-1 |
13P, 678N |
�����E�X�J���ʡF���U�����ݯS���A���L�{? |
Gabriel 2005 |
| NP |
319K |
| NS-1 |
92E |
�b�ޤ��P�i�}�ѥͪ��K�̤����A��ֽޤ����f�r�M�� |
Seo 2004 |
�{�ɪ��{
�q�`�Ƥ� (�u�����i�H��21��) �������A���j�����S�x�B���ت����q�B���ءB�������~�֦өw�A�������V�y�P�{�ɪ��{�O�i�ܪ��A�Ө�f�x�O�ᬰ���W�S��
(Elbers 2005)�C�]���A�u�a�{�ɪ��{���E�_�O���i��C
�P�V�C�P�f�ʸV�y�P�f�r�᪺�f�x�η|�O�ݰ_�Ф�A�J���q�u�ȴ�֡A�魫�U���ݦ����L���I�l�D�e�f��(Capua
and Mutinelli 2001)�C�@�ǧC�P�f�ʫ~�ءA�p�Y��H9N2�Ȭw�@�t�A�b�a�V���A���F���IJv�ƻs�A�i��|�ް_��h��۪��x�H�H�έ��j�����`�v
(Bano 2003, Li 2005)�C
�ܩ�䰪�P�f���A�b���Τ������e�f�|����M�X�{�Y���f�x�Φb48�p�ɤ���F�P100%���`�v���S�x
(Swayne and Suarez 2000)�C�b�P�V�s���������}�i�Φ��өw: �δݾl���Φb�����ʪ�������IJ�βV�X���a��}�i���b�s�A�ǬV�f�������|���bŢ���}�i���֡A�������P�V���ݼƤ�
(Capua 2000)�C�Ө��v�T�������u���b�٪��@�����C�ܦh�������O�S�������a���`�A�ҥH�̪즳�ɷ|�h�ìO�Ѥ��r�ް_��
(Nakatami 2005)�C�ȱo�`�N���O�A�S�w�����P�f�ʸV�y�P�f�r�j�����η|�b�@�V���~�ؾɭP�Y�����e�f�A���b��L�~�ثh���|:
���䪺���a�V�����b1997�~�o�������ڸs�ƥش�֫e�A20%�����A���u��2.5%�n�Z�A�t��H5N1���P�f�ʸV�y�P�f�r�C�Ө�L���ΥءB���Υؤ��x�Υث~�ت��f�r���ե����e���ʡC�ƹ�W�u��������ܥX���{�ɯe�f
(Shortridge 1998)�C
�b�u�~�ƪ��a�V�}�i�a�A���έ������Ӫ���t�W�ɫ�X�{�v���U������@���b�s���s�b�t�Ωʯe�f���H���C��ͳJ���a�V�A�J��������O�Q�����㪺�C�ӧO�P�V���P�f�ʸV�y�P�������q�`�|�i�{�h�ֳ\�Y�����N�H���R��
(Kwon 2005)�C�i�����Y���[�ʦФ������~�A���a�B���λL���o��A�e��⪺���m�ΦY�O���I�l�η|���@�P�a�s�b�C�b�ͳJ���a�V�A�̪�|����n�ߪ��J�A���H�ӯe�f���o�i�A�ͳJ�����ʷ|���t�a����
(Elbers 2005)�C���g�t�Ϊ��f�x�A�]�AŸ�ݡA�����`������ (���V)�A�H�Ψ�հ��D
(�B�ʥ���) �b�n�B�Z�B����������ܸ��z���~�ت����p���F�D�n���a�� (Kwon 2005)�C1979�~�b�w�꼻�J�����Ȧ{�o�ͪ����P�f�ʸV�y�P�z�o�A�b���������Z�j��a¶�ӯ������O�̦�������x�������@�H�P�쳡�h�÷P�V���P�f�ʸV�y�P�C
�V�y�P�P�V�H�����{�ɪ��{�|�b�u�H���y�P�{�ɪ��{�v (Clinical Presentation
of Human Influenza) �o�@�����ԲӰQ�סC
�f�z��
�C�P�f�ʸV�y�P
�����ê�H�ӯf�r�~�ؤαJ�D�����ݤΦ~�֦��ܤơC���M�ӻ��A�u�������������|���{�X��ۤηL�p�����ܡA�S�O�O�A���o�DZJ�D���~��
(Capua and Mutinelli 2001)�C�b�������A�w�d�X�����u���B��� ���ή��n���A���o��i��O�ѤG�ůf�r�P�V�ޭP�C����������Ŧ���w���Ҵy�z�C�b�����A�I�l�D�����L���o�s�O�`�����C���~�A�ͳJ���V���������ê������ʹ��x
(�Z�_�B��Z�ޡB�Z���ʸ�����)�C
���P�f�ʸV�y�P
���P�f�ʸV�y�P�b�f�z�Ǥβ�´�f�z�ǤW����ۧ�����ܥX�P�{�ɪ��{�ۦ����̿�ʡC�Ȯɤw���]�X�|�دf�z�ǧ���
(Perkins and Swayne 2003) :
- ��� (�P�V��24��36�p�ɤ����`�A�D�n�b���Υ��[��o��) �μ@�P�����e�f�S����ܥX�S�O��۪��f�z�ǧ���:
���@�P���y�z�A���������ߥ]�n���A���L�z�D����A�z�t���Τߥ]�߽����M�ﴳ�X�� (Mutinelli
2003a, Jones and Swayne 2004)�C�P�VH5N1�Ȭw�@�t�����������|�i�{�X�崳�ή�ޤ��|�X�{�۷����q���H�G
(Elbers 2004)�C�b��ĤΪͤ��~�]�i��|�X�{�߲G�ʺ��X���C�L�����ǤW�`�`���ԭz���e�G�H�����ֶq�X��A�u�O���`�a�b�P�VH5N1�Ȭw�@�t���a�V�I��
(Elbers 2004)�C�\�h��´�f�z�Ǫ������ê�H�ίf�r�ܭ�i�H�q���P���x�������o��
(Mo 1997)�C�f�r�����O�b���ֲӭM�o�{�C��ӡA�P�V�f�r���ӭM�i�H�q�ߦ١A�ǤW���ί�Ŧ�����X�C���g���H�θ�������ӭM�]�|���P�V�C�P�f�ǤW�A�i�H���w�P��L���֯f�r���ۦ����i�{�A�Y���֤Υզ�y���Ʒ|�ɭP�t�ΩʤΤ���զa����ӭM�]�l�A�e���ޭP�ߪͤΦh���x�I�h
(Feldmann 2000, Klenk 2005)�C
- ���ɶ��X�{�f�x�ίf���S�O�����ʪ����A���g�t�Ϊ��f�x�β�´�f�z�ǤW���D���w�ʸ�����l�`���F�@�w���a��
(Perkins and Swayne 2002a, Kwon 2005)�C���O�A�f�r��i�q��L���x�j���X�ӡC�o�L�{�w�b�Z�B�n�B�����Ψ�L����W�P�V���P�f�ʸV�y�PH5N1�Ȭw�@�t�����ݤ����Ҵy�z�C�ܩ�ͳJ�������A�|�X�{�Z�_�B��Z�ު��o���A�H�Φb�Z�w�}���᪺�ҿקZ���ʸ������C
- �b�n�B�äήa�x�³��A�u�o�{������f�r�ƻs�C�o�dz�����ܥX���L������ʪͪ��A���n���H�ζ����ʲO�ڤβ�´�ӭM�ߦ٪�
(Perkins and Swayne 2002a, 2003)�C
- �bPerkins�MSwayne (2003) ��������i���A�ҹ��F�l�μڱ�������H5N1���P�V�C�M�ӡAWerner���H
(�N�|�Z�n) ����Ϊ���L�������P�f�ʸV�y�PH5N1�j�����b5/16���F�l���A�]�D���w�ʸ����A�ް_�����g�t�ίe�f
(Klopßeisch 2006)�C
Ų�O�E�_
�b���P�f�ʸV�y�P��Ų�O�E�_���A�]���H�U���e�f����O�ް_���H�����`�v�����a�Φ���媺�e�f��M�o�f�A�ҥH�@�w�n�Ҽ{����:
- �j�r��åd�����E
- �ǬV�ʳ��ު� (��)
- �n�E
- ��ʤ��r
- ��ʮa�V�N�� (�ڴ��w��߯f) �Ψ�L�Ѧ�g�e�f
- ���a�Φ����ӵߩʸ��۲�´��
�����Y�������P�f�ʸV�y�P�����b�{�ɤW�i�H��V�áC�ҥH�A�ֳt������E�_�䴩��Ҧ��i�@�B�����q���Q�����n
(Elbers 2005)�C
����E�_
�����˥�
�˥����ѷs�A���ʪ�����ίf���s�����C�z�Q�a�A�A����ˬO���έp�W������ӶE�_�O�̾ڸV�s���C������˥��h�æs�����P�f�ʸV�y�P�ɡA�@�w�n�`�N�w���зǨ��קK�˥������̱�IJ���b���ʪ��H���Ǫ����P�f�ʸV�y�P�f�r
(Bridges
2002)�C����e�f���v���ߤw���X���������� (CDC
2005)�C
���f�r�Ǥ���A�Ѫn�ĤΤf�|��o�����l�@��|�Ҽ{��i�a�������s�C���l�W�����쪺�������V�X��2-3�@�ɧt���ܥͼW�ɤγJ�շ�
(�p 0.5% [���q����n��] ����M�J�աA�h�� 10% ����M�θ��߮��G)���L�ߵ������B�e�G���C
�b�w�����קK�e�f���������p�U�i����͡A�i�H�����츣�B���/�͡B��Ŧ�θz�t�q���S�O�ü˥��ӹj���X�f�r�C
����M�γ~�A�|�����ѵM����G�˥��C�����쪺�˥��ƶq��������30%�y��{�ת��]���F��95%�m�H�϶����˴��C
�˥��B��
���l�B��´�Φ�G���H�N��������B�����p�U�B��C�Y�w�p�b�B�e�i�{���|���W�L48�p�ɪ����~�A�o�Ǽ˥����n�ᵲ�ΥH���B�i��B��C�b���p�U�A���Ӥ@�����e�a���u��q�w���W�h
(e.g. ��ڪŹB��|����) ���קK�b�B��L�{���Ǽ��e�f�ηN�~�a��IJ����u�C�b�H�X�˥��e�A�Ʀܧ�z�Q�a�A�����˥��e�A�ƥ��p�����w���E�_����ǬO�D�`�A�����C
�E�_���p
�V�y�P�f�r�P�V����������
�W�A����� (�ۦ�) ���E�_���q��k�չϥh (i) �ζDzΪ���k�j���f�r�νT�w��ȫ��H��
(ii) �q���l�N����k�˴��Τ���f�r����]�աC
(i) �ӺD�ҡA�V�y�P�f�r�O�j���۳q�`�g�����n���~�|�A�N���l�G�β�´�ü߱��ئ�9��11��j��F�L�����J���L�{
(Woolcock 2001)�C�̭P�f���A�b5�骺�[������F�L�|�Τ��|���`�A�ӳq�`�b�F�L�Χ������S���S�O�������ê
(Mutinelli 2003b)�C���ؤF�t�����P�f�ʸV�y�P�f�r�����誺�J�A�q�`�|�b48�p�ɤ����`�C�b�ұo�����n�]�����X�����徯���s�b�C�微����
(haemagglutination, HA) �O�@�Ӥ��ӷP���N�A�ݭn�C�@�ɦ��̤�106.0�ɲɤl�C�p�����餤�u���C���f�r�@�סA�Y�ǧC�P�f�ʸV�y�P�f�r�~�ةλݭn�̦h�⦸�i�@�B�q�L��F�L���J�A���F��������f�r����HA�˴��o��C�ܩP�f�ʸV�y�P�f�r�A�ε}���������鰵�ĤG�����q�L�Φ��Q�媺�z�Q���͡C
����j�����q�L�ܾ������ (HI test) �b�ܭ�W����A��16H�ȫ��A�ι�Ӫ���P�ˮi�{����@�Ϊ����P�����V�����H�G�f�r��(��)�S���ܦ�M�C���g�i�ĞJ����A�P�˻ݭn�ȫ��S����M�A�i�b�����w�XNA�ȫ�
(Aymard 2003)�C���p�J��H5��N7�@�t���j���� �A�ݭn���w���R�߭P�f���� (intravenous
pathogenicity index, IVPI) �Ӥ���C�P�f�ʤΰ��P�f�ʪ��ͪ���
(Allan 1977)�C�o�i�H��10��6�g�j�����P�b�J�ͪ����f�r�j���� (0.1�@��1��10�t���W�L1��16HA�w�w�ת����n�G)���R�߱��عF��C�o�������|�Q�[��W�L10��Ӭd�ݨ��{�ɯf�x�C�䵲�G�|�X�֬����ơA��o���ƭȤj�L1.2���ܴN���ܦ����P�f�ʸV�y�P�f�r�C�Ϊ̡A���̤�10����7
(75%) �w���ت����b�[��������`�A�N�N���J�찪�P�f�ʸV�y�P�f�r�j�����C
�w�y�z���DzΨB�J��P��5�Ѥ������P�f�ʸV�y�P�E�_�A���έn�W�L��P���ӱư��V�y�P�f�r���s�b�C�ӥB�A���~�誺�E�_�u��
(SPF�J�AH��N�ȫ��S���ܦ�M) �ΰ��N�H���O���i�ʤ֪��C�{�b�A�S����F���F�L���J���ӷP�ת��ӭM���i���Τ�k�ӹj���V�y�P
(Seo
2001)�C
(ii) �@�ӧ�ֱ�����k�A�S�O�O�ݭn�ư��P�V�ɡA�N�O�Q�ΦP�˨̷ӯ��p�Φ������l�N:
�q�L��w�̰��O�@���y�P�f�r��]�դ��` �w M��]�������f����E�X�J����� (RT-PCR)
(Fouchier 2000, Spackman 2002)�A�ή֦�߰�] (Dybkaer
2004)�A�˴��X�ҫ��y�P�S��RNA���s�b�C���e���ʤ����ɡA�|�ϥΩ�jH5��H7�ȫ����微���J�հ�]������RT-PCR���˴��X���ݳ��i�åͷ������V�y�P�f�r���s�b
(Dybkaer 2004, Laboratory Diagnosis 61 Spackman
2002)�C�p�S�e���ʡA�b�ƧǸ�V���J�հŤ����I��HA��]������A�i����P�f�� (�C�P�f���ﰪ�P�f��)
�����l�E�_�C��ܦ��h���P�ʮ��Ī��j�����|�Q���������P�f�P�V�y�P�CPCR�Ψ�LDNA���էN���Q�]�p�@H5N1�Ȭw�@�t�~�ت������k
(Collins 2002, Payungporn 2004, Ng
2005)�C�DH5/H7�ȫ��i�H�ѼзǪ�RT-PCR�H���H�᪺HA-2�ȳ��ǦC���R�T�{
(Phipps 2004)�C�ӥB�٦���C��NA�ȫ����S�w�ޤl�C���㪺�y�z�Υi�b�T�Ѥ������A�ר�O�ϥι��PCR�N(Perdue
2003, Lee and Suarez 2004)�C�M�ӡA����i�@�B�����V�y�P�f�r���R�IJv��DNA�������b�o�i����
(Li 2001, Kessler 2005)�A�ϱư��E�_��b�@�Ӥu�@�Ѥ������C
���l�E�_��k�����I�O�Ψ��ʶR�����ή��ӫ~������C���L�A�Y���o��A�۹�b�J���j���f�r�A�ܦh�˥�����Ѹ��֪����u�b���u�ɶ����i����R�C���O�A���ण�ӻ{�A�P�J���j���f�r�ۤϡA�C��PCR����������]�t�F����j�����b�ޤl��/�α��w���X���I�s�b�S�w���ܪ����b���T�w�]���A�η|�ɭP�˴����ѤΧe���ʡC
�ҥH�A�p�X���l (e.g. �@�z��γ~) �ζDzΤ�k (e.g. �@�̫᪺�j��������Φb���ƤW�@�E�_�T�{)
�i��U�����o��ح�z�����I�C
�ֳt���դw�Q�]�p�X�H�K�̿å��k�@��´�L����ΧC�Ť������f�r�ܭ��˴��A�ΥΧ��鮷���J�p�K�̧l�����w
(ELISA) �Ϋ��l�G���ձ����V�y�ʨt�ΡC��ثe����A�o�ǧN���f�r�j����PCR���ӷP�A�ҥH�γ\��������@�㦳�k�ߤW�������E�_�A
�ר�O���Ъ��Ӯ� (Davison 1998, Selleck 2003, Cattoli
2004)�C�ε���������b�~��ɪ��ϥΤ]�u�O�b������q�A�ӥB�ݭn�i�@�B���o�i�C
�V�y�P�f�r�P�V����������
�ھگb�s����M�ǩΦ��U��z��γ~ (Beck 2003)�C�ܩ���M�˥��A�ΥͳJ�V�����Z�������V�y�P�f�r�S��������աA�Q�ΰѦҪ��ȫ��ܭ쪺�ܾ���
(HI) ���礴�M�N���ӳ̦n�������зǡC��֦�߳J�ժ����ݯS���ʧ��� (�ҫ��y�P�f�r)
�]�i��ã�����K�̨I�������ΞJ�p�K�̧l�����w (ELISA) �˴��X (Meulemans
1987, Snyder 1985, Jin 2004)�C�v���ʪ�ELISA�Φ����\�Ҧ������~�ئ�M���ˬd�A���������ݯS����X�����i�o��
(Shafer 1998, Zhou 1998)�C�{�����ɤ@�رM��H7�������窺ELISA�Φ�
(Sala 2003)�A���{�b���S�����إi�H�Χ@�V����M�M��H5�S�����骺����C
�ȫ��S������ʤO�ǵ��G�f�r�ت��S�x�ΥD�n���G�J�D�����өw�C�b�L�����V�����A�V�y�P�S������b���H�f�r�J�I����ӬP�����T��a�ܱo�i�˴���;
�Z����������b���~�Ƥ��i�H�˴��o�� (Beck 2003)�C�n��ت����鲣�ͤ������O�h��
(Suarez and Shultz-Cherry 2000)�C
�P�V
���������P�V
�C�P�f�ʽd�V�y�P�f�r�b���ͤ��V����ǤWí�w (Webster 1992)�C���������P�V�g���̱ƪn���Τf�ĶǼ���өw�C���J�D��J�D�������Ǽ��~�A�q�L���f�r�ìV�����ΦìV�������������O�@�ӭ��n���~�|�A�P�������ʪ�
(�H�B�ޡB��) ���M�ѭ��j�Ǽ����y�P�f�r�P�V���P�C�b�����A���q�X�b�C�J�T�K���t�۷���108.7
x 50%�V�F�P�V�q (EID50) ���̰����ƪn�w�w�� (Webster
1978)�C�����w�w�h��j�T�צa�C�ǡC�V�y�P�f�r��ܥX�@�ӥO�H�_�媺�A�b���Ҥ��]��O�s�P�f����O�A�S�O�O�����]�i�O�d�ǬV�ʡA���M��κA�Ǫ����W���G�O�ܮz��
(Stallknecht 1990a+b, Lu 2003)�C�������f�r�a�B�G�w�ҹ�b17�J�|�O�d�ǬV�ʶW�L100��C�f�r�i�b�C��-50�J�L�����a�x�s�_�ӡC�ھ�
Ito���H (1995) �� Okazaki���H (2000)���ƾڡA���ѤF�Ҿ���ܸV�y�P�f�r�b�j�_�Ϫ��V�ѡA�b�ʥF��E���ѵM�J�D�����p�U
�A�O�O�s�B������C�b�H��u�`���F�c�ަӦ^�k��A��^�~���������Ψ�����v�T����N�A�|���M�a�Q���ƪ����Ҥ������X���f�r�P�V�C�u�ӳo�Ǥ覡�A�w�����]���V�y�P�f�r��O�s�����ҦB�@�q�S�O�����ɶ�
(Smith 2004)�A�ӥB�η|�q�o�x�s�w�N�j�N���f�r�ΰ�]���`���Q�� (Rogers
2004)�C
�ͪ��w�����I �A���b�j���j�q�a�V�i���A���Ħa�w�������������z�覡�Ǽ��A�p���ìV���]�ơA��q�u��A�}�ơAŢ�A�Φ�A�A�S�O�O�c�C1999/2000�~���N�j�Q���P�f�ʸV�y�P�a�V�y��f�����R��ܥX�U�C���Ǽ����I:
���P�V�V�s������ (1.0%)�A�a�V�B��ܱO�_���~����������IJ (8.5%)�A���P�V�g����a���@�����b�|�F��a��
(26.2%)�A�Χ@�B�e�}�ơB�ԯ�ΰʪ����骺�f�� (21.3%)�A��L�q�L¾���B�u�@��������������IJ��(9.4%)
(Marangon and Capua 2005)�C��N�j�Q�a�V�y��ɪ��Ů�Ǽ��S����������u���C�M�ӡA�b����
(2003) �Υ[���j (2004) ���z�o�A�N�Ҽ{��Ť����Ǽ� (Landman and
Schrier 2004, Lees
2004)�C���ǬV�C���A�p�j���ذʪ��λa�ǡA�η|�R���u����ʶǬV�C���v�ӥL�̦ۤv���|���P�V�A��@�Τ����M���a�T�w�A���֩w���|�c�����n���]���C
���P�f�ʸV�y�P�f�r�Ѯa�V�A���ǤJ�����s�ä���ۡA���ܰ��P�f�ʸV�y�P�f�rH5N1�Ȭw�@�t���X�{�C���O�A2005�~4��A�X�{���_���C����H5N1�Ȭw�@�t���p���e�f�A�v�T��Ƥd�����Y���Ψ�L�n�B�����B�ê��E���~��
(Chen 2005, Liu 2005)�C�]���A�b��᪺�w���[�����A�@�w�n�Ҽ{��H5N1�Ȭw�@�t�f�r�g�����Ǽ����~�|
(�b�U���|�Q��)�C
�۱q2003�~���A�b�Ȭw�o�{���@��H5N1�f�r�A���������P�f�ʡA�����n�h���O(Sturm-Ramirez
2005)�C�Q�γo�ǹj����������ʷP�V��ܥX�۹���]���R�βӭM���i�����ߴ��Φ���O�����زV�X
(Hulse Post 2005)�C�q�o�ǹj�����P�V�ͦs���n�ҹ�|�b��17��h�����h���n���P�f��O���f�r�ڸs�C�����{�ɯg���ӿz�着�������P�f�ʸV�y�P�f�rH5N1���s�b�ɡA�n���i���ܦ��f�r���u�차�v
(Webster
2006)�C
��H���P�V
�V�y�P�f�r�ǬV�H���A�ޭP�{�ɤW���㪺�e�f�O�Q���u���� (���T)�C�b�F�n�ȼƥH�ʸU���H����b�i����S�P�f�ʸV�y�P�f�rH5N1�A��ڤW���G���H���ӮƦr�A���M�b�L�h�X�~���_�W�[�A�����Q�����۹�a�C(http://www.who.int/csr/disease/avian_influenza/country/en)�C
���P�f�ʸV�y�P�f�rH5N1�Ȭw�@�t�P�H���I�l�D�e�f�����Y�����b1997�~���[���A���ɨ�H5N1�P�V��18�H����6�H���`�C�o�ǭӮצb�y��f�ǤW�P���a�V���������P�f��H5N1�z�o����
(Yuen 1998, Claas 1998, Katz 1999)�C���P���P�V�����a�V�B�Q���T�K�Y���ìV�������Ϊ��K����IJ���H�AH5N1�f�r�ѳ����P�V�H�������I�̰��C�O�_�B�h��B�c��ηdzƵN���L�{�����S���I�Q������
(http://www.who.int/csr/don/2005_08_18/en/)�C���P�f�ʸV�y�PH5N1�Ȭw�@�t�f�r����b�������骺�Ҧ���´
�w �]�A���Ϊ��פ����C�b�@�ǨҤl���A�����i���X�N�f���O�_�ηdzƧ@���Ϊ��H�o�i�X�P�R���e�f�A���@�_�ο����a�x�����h���|
(http://www.who.int/csr/don/2005_10_13/en/index.html)�C
���T. �w���G���V�y�P�f�r�H���P�V*
| ��� |
��a/�a�� |
�~�� |
�Ӯ� (���`) |
�g�� |
���Y |
| 1959 |
���� |
H7N7** |
1 |
�I�l�D |
���~�ȹC |
| 1995 |
�^�� |
H7N7 |
1 |
������ |
�d���n (�P�E�p�������ɴ��) |
| 1997 |
���� |
H5N1** |
18 (6) |
�I�l�D/�ͪ� |
�a�V |
| 1998 |
���� (�s�F) |
H9N2 |
5 |
���� |
���� |
| 1999 |
���� |
H9N2 |
2 |
�I�l�D |
�a�V; ���� |
| 2003 (�G��) |
���� |
H5N1** |
2 (1) |
�I�l�D |
���� |
| 2003 (�T��) |
���� |
H7N7** |
89 (1) |
������ (�P�R�Ӯ|���ͪ��ΩI�l����) |
�a�V |
| 2003 (�Q�G��) |
���� |
H9N2 |
1 |
�I�l�D |
���� |
| 2003 |
�ì� |
H7N2 |
1 |
�I�l�D |
���� |
| 2003 |
�V�n |
H5N1** |
3 (3) |
�I�l�D |
�a�V |
| 2004 |
�V�n |
H5N1** |
29 (20) |
�I�l�D |
�a�V |
| 2004 |
���� |
H5N1** |
17 (12) |
�I�l�D |
�I�l�D |
| 2004 |
�[���j |
H7N3** |
2 |
������ |
�a�V |
| 2005 |
�V�n |
H5N1** |
61 (19) |
�I�l�D |
�a�V |
| 2005 |
���� |
H5N1** |
5 (2) |
�I�l�D |
�a�V |
| 2005 |
���� |
H5N1** |
7 (3) |
�I�l�D |
�a�V |
| 2005 |
�Z�H�� |
H5N1** |
4 (4) |
�I�l�D |
�a�V |
| 2005 |
�L�� |
H5N1** |
16 (11) |
�I�l�D |
�a�V |
| 2006 |
�g�ը� |
H5N1** |
3 (3) |
�I�l�D |
�a�V |
* �ӷ�: Avian influenza - assessing the pandemic
threat. WHO, http://www.who.int/csr/disease/influenza/WHO_CDS_2005_29/en/,
�n�J 06 January 2006
**��a�V�����P�f��
�@��H9N2�~�ئb1999�~�ɭ���S�O��F�Ϫ���W�p���A�H��2003�~�Q�G�뤤�ɤ@�W�p���A�ް_�F���L���A�y�P�����f�x
(Saito 2001, Butt 2005)�C�o�Ǵ����y�ǩ�a�V��H9N2�~�ءA�b������������ܫD�`�z���~�ءA�ɭP�F���j���f�x�έP�R�v�C
�ھڬ����A�S���Ҿ���ܫ���a�N�����a�V�����ήa�V�s�~�OH5N1�Ȭw�@�t�H���P�V�����Y�C�̷ӺD�ҡAWHO��ij�n�N���������N���A�O�������Ҧ��������F��70�J�����ūסC�b�o�ūסA�y�P�f�r�ܱo�����A�]���ܱo�w���A�קK�Y�z�ͪ��a�V������H5N1�f�r�ìV
(WHO
2005)�C
���L�������ʪ����P�V
�V�y�P�f�r�b�@�DZ��p�U�|�ǬV�줣�P�����������ݡC�o�ɡA���ӽƻs�ξA���g���A�|�o�{�s���y��@�t�C�ר�O�ޡA�W�c�a�o�A�J���ءu�����A���v�C�b�ڬw���s���A�����V����H1N1�f�r�O���ײ��檺
(Heinen
2002)�C��1992�~�b�^�ꭺ���j�����H���V��������f�r�AH1N2�f�r�A������a�W�K���
(Brown 1998)�C�b����A���y�q�ӶDz�H1N1�B�H��H3N2�θV���ȫ������T��������
(H3N2) (Olsen 2002)�C��L�j���O����V�����ȫ� (e.g. H1N7�AH4N6)
�D�n�c�Ʀa�b�ޤ���� (Brown 1997, Karasin 2000)�C�@�إX�۸V����H9N2�f�r�b����F�����s���@��a������
(Xu 2004)�C���ޤ��~�A���v�������ʪ��ΰ��Q�ҹ�|�ѸV�����Y���o�ҫ��y�P�f�r (Guo
1992, Ito 1999)�C
���g���y�z�������ʪ��骺�Ѫ�Ψ�L�j���߬�ʪ��A�Q���H�f�r�e���ʪ��������A�۵M�a�P�VH5N1
(Keawcharoen
2004, Quirk 2004, Amosin 2005)�C�֦������`�v���Y���e�f�]�ӱ����
�ӡC�ӥB�A�߬�ʪ������Ǽ���M�o�ͩ�P�@���ʪ��� (Thanawongnuwech
2005)�C�o�O�Ĥ@�v�߬�ʪ��P�V�y�P���ӮסC�a�x���ڬw�u��߯�b���礤�P�VH5N1�f�r
(Kuiken 2004)�C
2004�~�A�Ѧb�V�n�ۥѺ��C���������3000�Ӧ�M�˥��ΨӶi���M�Ǫ����աA�j�M�O�_�����V��H5N1�y�P�f�r
(Choi 2005)�C�f �r���M����Φ����{���R�T�{�F�u��0.25%���˥��O�e��M�������ʪ��C�b����ʷP�V�A�ҹ�ޯ�Q�j����2004�~�Ȭw�H���θV�����Y��H5N1�f�r�P�V�C���L�y�¤���ŤW�ɬO�b�P�V��4�餺�[��쪺�Ȧ��f�x�C�f�r�i�b�̤�6�餺�j���ۤW�I�l�D��´�C����l�G�b�P�V��2��o�X�̰��f�r�w�w�סA���S������ʷP�V���ʪ��N�ǬV�ܱ�IJ���ް��C�b�Ȭw�y�檺���P�RH5N1�f�r�ݨӥi�H�۵M�a�P�V�ް��C�M�ӡA���˪��P�V���o�Ͳv��M�a�C�C�S���Q���ժ��V���ΤH��H5N1�f�r��e���a�b�������ҤU���ް����Ǽ�
(Choi 2005)�C���o���[��A�ް��{�b�j�����|��H5N1�Ȭw�@�t���y��f�ǰ_�@�ӭ��n���@�ΡC
2003�~�K�b�����B��Q�ɤμw�ꪺ�a�V���A�o�Ͱ��P�f��H7N7�V�y�P���z�o�A�ް_89�Ӽ��S����P�V�ʪ��Ϋ��骺�a�V���u�A���ͷP�V�λ��L���e�f�A�j�����ݵ�����
(Koopmans 2004)�C�@�~�媺�P�V�ɭP��ʩI�l�x�����g���A�ܦ��V�P�R����V�o�i
(Fouchier
2004)�C���~�A�����z�o�ɡA�b�f�r�ǤΦ�M�ǤW�T�{�F�@�Ǯa�x��H7N7�P�V�A�䤤�|����ܦ�������
(Du Ryvan Beest Holle 2005)�C�b�N�j�Q�Τ饻�A���Ҿ���ܦb��L���p�U���H������H9�AH5�AH7�ȫ����C�P�f�ʸV�y�P�f�r�~�ت��L�g���۵M�P�V
(Zhou 1996, Puzelli
2005, Promed 20060110.0090)�C
�b�@�c�Ƴ��i (Promed Mail 20050826)�A���ΥX�ͩ�V�n��a����}�T���T���u���G�l�W(�e��)�ѩ�H5N1�y�P���P�R�P�V�C�P�V�����Y���ݥ����T�C���b�F��Ţ�����t�~20���P�تG�l�W�A�h�S���V�f�C
�V�y�P�f�r�q�S���b�ѹ��B�ըߤΨ�L�b���䬡�����������s�b�����P�������ʪ����o�{�A�Ӧb�o�ǥ����N��20%��������H5N1�Ȭw�@�t�e����
(Shortridge 1998)�C
�y��f��
�a�V
����2003�~���A���P�f�ʸV�y�P���Q�����a�V�u�����e�f�C�q1959�~�_�A���@�ɥu��24�v���z�o
(���@)�C�h�Ƴ��O�o�ͩ�ڬw�ά��w�C�j�������z�o������a�z�W������A�u��5�v�ɭP��۪������ܲ��h���A���A�ӥu��1�v�b��ڤW�����C�S���@���z�o���g�F��2004�~H5N1�Ȭw�z�o���W��
(WHO
2004/03/02)�C�ھڬ����A�Ҧ����P�f�����z�o���O��H5��H7�ȫ����ҫ��y�P�f�r�ް_�C
�b�L�h���z�o���A���P�V�����Ψ䥼�g�B�z�s�~���D�k����β��ʡA�H�γq�L�H������ (�ȫȡA������)
���f�r���D�G�N�����z�ǻ��A���O�Ǽ����P�f�ʸV�y�P�f�r���D�n�]���C
���P�f�ʸV�y�P�z�o���s�W�Ҧb2003�~���ܱo����C�q2003�~12�뤤��2004�~2���A�b����B�V�n�B�饻�B����B�Z�H��B�Ѿ�B�L���Τ��ꧡ���X�A���Ѱ��P�f�ʸV�y�P�Ȭw�@�tH5N1�f�r�b�a�V�ް_���z�o�C�a�V�����P�f��H5N1�y�P���s�x�y��b���P��a�P�ɥX�{�O�v�L�e�Ҫ��C�Ҧ��H�o��o�e�f���ؼЪ��V�O��ثe����O���Ѫ��C����1.5�����������_���γQ�j����AH5N1�b�L���ζV�n���ܦh�a�ϡA�H�άZ�H��B����B����M�]�\�Ѿ⪺�@�Ǧa�ϡA�{���Q�����a��ʯe�f�C
���Ӫ��f�r�A�b1997�~�����J��A�O�X�ۭ��s�ƦC�զX�ӷ����A�]�A�̤֤@�خa�x�Z��H5N1�f�r
(A/goose/Guangdong/1/96�A�I�XHA) �Τ@�ؤj���Ӧ۵u�V���n��H6N1�f�r
(A/teal/Hong Kong/W312/97�A�I�XNA�Χ@�����J�ժ����`)�C�o�f�r�g����h��h�P��L�����V�y�P�f�r�����ƶg��
(Xu 1999, Hoffmann
2000, Guan 2002b)�C�{�w��H5N1�@�t�ƭӤ��P��]�����y�z (Cauthen
2000, Guan
2002a+2003)�C�ҿת���]���uZ�v��2003�~12��}�l���z�o�����F���n���a��
(Li 2004)�C
�M��2005�~4��A�F��F�t�@�Ӱʪ��y��f���{�סC�o�ɡA�O�Ĥ@���AH5N1�~�د���j�q�a��IJ�쳥���s
(Chen 2005, Liu 2005)�C�b�����_�����C����A�Ƥd�����Y���A�@�ؾE�p���ݡA�]���P�V�Ӧ��`�C�ƭ��ä������~�ؤ]�b�o�a�Ϩ���v�T�C�b2005�~�L�u�ά�u��A�����b�a�z��m�F�X�j�B���ħJ�Ϋn��B�Q�ȥX�{H5N1�z�o�A�h�ïf�r�O�ѾE�p�����Ǽ��C2005�~���A�Ѥ��Ȩ줤�F�ΫD�w�����|���Գ��E�p�~�|�W�Τ����A�Ϥg�ը�Bù�����ȡB�Jù�J��Ȧ@�M��ΧJ���̨ȥb�q�D����t�~���z�o�C�b�Ҧ��Ҥl
(���F�b�X�j�ΧJù�J��Ȧ@�M�ꪺ) ���A�o�{�a�V�γ��ͤ�����̳�����v�T�C�q�`�a�V�����ЭӮ׳����G�F���ͤ����Ϯ��������a�C���M�o�ݦ����X�@�ӾE�p�����Ǽ��f�r�������t�ܡA���ڭ����M���`�N��ثe����P�f�ʸV�y�P�Ȭw�@�tH5N1�f�r�u��q�����Φ��`�����ͤ������˴��X�C���ͤ����s����H5N1�u�����p�Ψ�b�Ǽ����Ҿ�������⤴�M�O�p���@��C�ثe�A�u����_���ͤ�����_�b�����ɱa�ӯf�r��ܻ����Z���A�Ϊ̬Y�Ǻ��ݾ��ި�H5N1�P�V���T���O���i�ʡC
�M�ӡA�b�o�䶡�A���ꪺ��s���S�X�³����s�b�ӧ�h�Ȭw�@�tH5N1�f�r���s��]�� (Kou
2005)�C�j���X�f�r���³��ι��礤�P�V�o�ǯf�r���n�A��̳��S�����{�X����f�x�C���ɡA�b�Ǧ�������A�h�ɭP���������P�f�ʸV�y�P�C�ѩ�P�@�V�s�J�����P���³��a�Ӽƭӥi�ϧO�X����]���A�ӳo�ܥi��O�Ѥ��P�����X�B���V�y�P�f�r���ƧΦ��A�]���O�H�h������H5N1���f�r�b�Y�z���ɶ�(���?)�e�w�g�Ǧܳo�dz����C�o�Ǹ�ƪ��ܥX�t�@�Ӵc�ƪ��B�J:
�³��A���e�̪��Ϯ��ߺD�A�O���ͳ����ήa�V���z�Q�����̡A�H�Υi��N���P�f�ʸV�y�P�f�r�b�o�DZڸs���ǰe�C�b����έ������X���a�ϩʭ���a�P�V���P�f��H5N1���ӧO
(�w�f�Φ��`) �³��C�P�H���w�~�a����K�pô�a�ͬ����P���������A�p�³��B�ڱ����οP�l�A�e�̤������P�f�ʸV�y�P�f�r���a�ϩʡA���ȹ���a���a�V�~�c�����j�����O�A�ӥB�W�[�H�����S��f�r�����I
(Nestorowicz 1987)�C
�H��
�I��2005�~12��30��AH5N1�H���Ӯפw��142�v�C�H�����y��ʲ{�u����Z�H��B�L���B����H�ζV�n�������I(�Ӯפ���65.5%)�C72�H
(50.7%) �w�]�����`�C
�ܩ��Ժɪ���ơA�i�Ѧ��D�ج��u�y��f�ǡv(Epidemiology) ���@���C
�g�٤W����G
���P�f�ʸV�y�P���z�o���@�A�ҤΨ��v�T�a�Ϫ��a�V�~�i���O�d�G�� (�����@)�C�g�ٷl���q�`�ѩ�a�V�]���P�f�ʸV�y�P���P�V���������`�u�O�䤤�@�����C�Ψӹw���e�f�i�@�B�X�������I�ɭP�F���j���l���C��i�l����o�i����a�ӻ��P�ˤ]�O��H���A�]���a�V�O�L�̥D�n���ʪ��J�ս�ӷ��C���z�o�ܱo�s�x��A�N��������A�ӥB�i��ݮɦh�~
(WHO
2004/01/22)�C
��ܰ��P�f�ʸV�y�P������I
�ѩP�f�ʸV�y�P��g�٪���b�}�a�ʽ����A���b���@�ɨ���ĵ���a���ʺޤ��Y�檺�k�W�Һި�
(Pearson 2003, OIE
Terrestrial Animal Health Code 2005)�C��ܰ��P�f�ʸV�y�����I�����v�T�a�Ϫ��y��f�ǧζզөw�C�b�ڷ��A���P�f�ʸV�y�P�ä��ݩ�a��f�A���M�O�T��ϥθV�y�P���w���ʬ̭]���C�]���A�ѩ���H���{�ɹL�{�A�a�V���z�o���P�f�ʸV�y�O�w������ۡC���G�A���墨�˪��z�o�A�N�n���i��������I�A�p�������P�V�λP��F�O���a�A�ت��O���F�ߨ�������P�f�ʸV�y�P�f�r�αN�z�o�����b����H���O���a�d�C
���F�o�ǥت��A����κʵ��ϰ�|�إߦb����H�a�쪺�P��A���|����a�өw (�b�ڷ��A���O�O3��10����)�C���P�V�ξF�A�����j���A�ֳt�����Ҧ����P�V�μ��S�������A�H�Χ�����m�ʪ�����A���O�w�����L�A�����V�Ǽ����зDZ���I
(OIE
. Terrestrial Animal Health Code)�C�b�z�o�����A���a�V�ήa�V�s�~�b�ꤺ�~�����ʭ���O�Q�����n���C
���~�A�Q�δ��դέ簣��ʦìV���O���a�ӧ@�a�V�C�P�f�ʸV�y�PH5��H7�ȫ�������A�ت��b���C���P�f�ʸV�y�P�f�r�q���ǫO���a���s�ͪ������I�A�o��D�a��f���a�ϩγ\�O������C
�o�ڰ��[�����S�����D�i��|�b: (i) ���K�a�V�ڸs (Marangon 2004,
Stegemann
2004, Mannelli 2005) �� (ii) ����p���p�H�O�H�a�@�a�V�ۥѺ��C
(Witt and Malone 2005) ���a�ϲ��͡C�ѩ�a�V�O���a����K�F���Ψ�u�~������c�y�A�e�f���Ǽ��t�פ�������I�֡C�]���A�b1999/2000�~���N�j�Q�z�o�����A���Ȩ��P�V�ξF�O���a���}�a�A�b���ìV�A�����b�|1���������P�V���I���V�s�]�j��ʳQ���C���L�A�ڰ��u�@�ݮɥ|�Ӥ�A�ӥB�n���@�d�T�ʸU���������`
(Capua 2003)�C��¶���ìV�A���@�ܼƤ����إߧ����S������a�V���w�Ħa�a��O2003�~������2004�~�[���j���\�������P�f�ʸV�y�P�f�r����]�C�ҥH�A���u�O�e�f�����A�ӥB�٦��ʪ����j��ʮ_���A�ɭP���O�T�d�U�Τ@�d�E�ʸU�����������C1997�~�A��������b�T�餺
(12��29�A30��31��) �_���F�Ҧ��a�V (�@�ʤ��Q�U������)�C�W�z���I�����ΡA���b�ߨ�������P�f�ʸV�y�P�f�r�ӥH�����S���P�V���������N���A�o��ӷ~�A���Ϋ����a�Ϩӻ��γ\�i��C�M�ӡA�o�|��a�V�~�a�ӭ��j���h�W�A�H�οE�_�������_���w�Ħa�a���ƥH�ʸU�p���d�ΨS���P�V�ʪ����D�w�Q�`���Y�C
�o�����I�A�b�H�DzΤ覡�}�i�a�V (���n��ۥѺ��C�A�P���ͳ����V�X�_�өΦ@�P���ɤ���)
���A���a�ϡA�O������檺�C���~�A�a�n�|�l���n�A���ѳ����ήa�V���Ǽ����@�ӭ��n�pô (WHO
2005)�C�o�DZ��p�η|���Ѱ��P�f�ʸV�y�P�f�r��o�a��ʪ��A����¦�C
�b�Y�a�Ϫ����P�ʸV�y�P�a��ʷ|���a�V�O���a�a�ӫ������O�C�ѩ�W�z�������b�S�����a���a�V�~�y�����j�l�`�A�ΨS����o�i����a�ް_�Y�����J�ս�����u�ʪ����p�U���ɶ������A�ҥH�@�w�n�Ҽ{��L�����I�C
�b�o�DZ��p�U�A���جO�Q�s�x�a�ϥΡA�ӥB�γ\��@���D�a��f�a�Ϫ��z�o���ڰ��L�{�������U��q�C
����
�b�~�媺�@�ɱ��جO�b�l�D�|�ӥؼ�: (i) �{�ɯe�f�����@; (ii) ���r�f�r�P�V�����@;
(iii) �f�r���c�������@�� (iv) ���ذʪ��P�V����M�ǰϧO (serological
differentiation of infected from vaccinated
animals; �Y�ҿת�DIVA��z)�C
�y�P���ت���줺�A���װӷ~�W�i�Ϊ��ι���W���ժ��̭]��ثe����S����ŦX�����o�ǭn�D��
(Lee and Suarez 2005)�C�Ĥ@�ӥؼСA�Y���@�Ѱ��P�f�ʸV�y�P�f�r�ް_���{�ɯe�f�A�j�������̭]���i�F��C�̭]���ت̷P�V���r�f�r�Ψ���c�������I�q�`���Q���C�A�����৹������C�o�η|�b���������ت��a��f�a�ϾɭP���j���y��f�ǰ��D:
�ݨӰ��d���w���س����i��w�R���a���P�V�A�b�̭]�����@�U���c�X�f�r�C���ĭ��C�f�r���c�ﱱ��I
(�Y���r�f�r������) ���D�n�ؼШӻ��O�Q�����n���C��IJv�i�H�ѽƻs�]�lr0�q�ơC���]�@���ؤΨ��P�V���V�s�����N�ǬV�f�Ǧܤ֩�t�@�ӸV�s
(r0<1)�A�b�ƾǥ߳��W�A���r�f�r�O�ɦV������ (van
der Goot 2005)�C�b�B�z��ܼ�b�ʰʪ��Ǽ���H5N1�f�r�����خɡA���C�f�r���c�]�|��C�ǬV�H�������I�A�]�����G�ݭn���j���f�r���q�Ӭ�L�����P�H�����������̻١C�̫�A���ëD�����n���O�ADIVA�N��e�\�b�w���س����H��M�Ǫ���k�l�d�f�r�P�V�C
�@����ڪ����ΡA�@�w�n���u�ƭӱ��� (Lee and Suarez 2005):
a) �ѩ�|����]���ƪ��i��ʡA�H��H5��H7�ȫ��۵M���ܦӼW�[�P�f�ʪ����I�A�̭]���i�H�Ѧ��ƻs��O���y�P�f�r�զ��C�ҥH�A���ʴ�r�̭]�w�Q�^�O�C
b) ��a�V�����P�f�ʸV�y�P���@�D�n�̿��HA���S���ʪ�����C�]���A�̭]�f�r���P�{���f�r�ݦP�@H�ȫ��C�z�Q�a�̭]�f�r�P�{���f�r�������k�X�A�p�P�ϥΩ�H�����̭]���n�D�A�b�a�V���h���O�j��C�ѩ�S���s�x�����ءA�{�ʥF�V�y�P�f�r���Ѭ̭]�X�ʪ��ܭ��Ʋ��A�b�a�V�����o�P����e�������K�̤O�γ\�w�����Χ@���@�C
c) ���ϥμаO (DIVA) ������ (Suarez 2005)�C�@����ܡA�Υi�ϥέ�L�����ӧ@�ʱ��C
�{�b�w�o�i�X�@�j�諸�̭]�����C�j�������M�H�����λ��U�ʪ�����f�r�̭]����¦�A�����ήɻݭn���O��C���ʪ��ϥΰw�Ϊ`�g���C
����ڰ��P�f�ʸV�y�P�~�ت������ƦP���̭]�A�|�ް_�A�����O�@�@�ΡA�����e�\��M�ǤW����̭]���ت̤Ψ��P�V�����C�ѩ�̭]�O�Ѳ{�ɪ����P�f�ʸV�y�P�f�r�s���A�b�̭]������ήɡA�|���T�������~�C
�ۤϡA�����Ʋ����̭]�A���̭]�f�r���F�X�P�{���f�r�ۦP��HA�ȫ������P��NA�ȫ��ɡA�i�H�Χ@�аO�̭]
(e.g. H5N9�̭]��H5N2���P�f�ʸV�y�P)�C�Q��NA�ȫ��S�����骺���w�A�������X�̭]���ت̤Ψ��P�V����
(Cattoli 2003)�C�M�ӡA�o�Ǥ�k�O�۷��Y�O�ӥB�η|�ʥF�ӷP�ʡC���M�p���A�����̭]�i�H�s��b�Ѽƺؾ֦����@�PNA�ȫ���H5��H7�ȫ��c�����̭]�w�C�ϦV��ǾǤj�j�a���U��s�y���~��������γ~��̨ϥΡA�ӻݨD��HxNy�զX�b�A�X��ǭI�������̭]
(Liu 2003, Neumann 2003, Subbarao 2003, Lee
2004, Chen 2005, Stech 2005)�C�{�ɡA�����Ʋ����̭]���b�F�n�ȥH�ξ�����B�ڰZ�Υ_�N�j�Q��H5N1��b�M�I�a�Ϲ�a�ϥ�
(e.g. Garcia 1998, Swayne 2001)�CNS-1�S�����骺���w�Q���X�@�������Ƭ̭]�ϥΤW�t�@DIVA�t�Ϊ����
(Tumpey 2005)�C�o�ǧ���b���w�w�פU�Ѩ��P�V�������͡A�����ϥΥ����Ƭ̭]�ɡA�|�b�۷��C�w�w�פU���͡C
���C�����լ̭]�b����P�V�a�V���f�r�βӵ߰��F�����{�X H5 �� H7 NA��] (e.g.
�V�k�f�r [Beard 1991, Swayne 1997+2000c]�A���ު��f�r
[Lueschow 2001, Veits 2003] �ηs�����E�f�r [Swayne
2003] )�C�ѩ�O���̭]�A�q�L���μQ�����j�q�B�γq�`���O�i�檺�C���M���\���T��DIVA���ѡA�M�ӹ�C���f�r���w���s�b���K�̤O�N�|�j�j�a��ê���ت����\�C�b������ά���w�����F�@�ǻP�V�k�����馳������a�g��C
�̲סA�����ҩ��F���ժ��{��HA�J�դΥ�HA���{���骺DNA���ت����\�ϥ� (Crawford
1999, Kodihalli 1997)�C
�F�n�Ȫ��ƭӰ�a�{���p���H����ʪ��j�W�Ҧ�ϱ��� (Normile 2005)�C
�e�f����y�檺���I
����y��e�f���o�ͻݭn�ŦX�T�ӱ���:
a) �ܤ֦b�@�ӤH���@�N�S�Q��ı���y�P�f�rHA�ȫ��X�{ (�ΦA�X�{) �M
b) �b�H��������Ħa�ǬV�νƻs �M
c) �b�H�����e���Ϋ���a�Ǽ��C
�o��ܷs���H���y�P�y��f�¯٨ä��O�ߤ@�a�P���P�f�ʸV�y�PH5N1���X�{�����C��ثe����AH5N1�u�ŦX�o�DZ��䤤���:
��D�`�j�������H���H�f�ӻ��A���O�s���ȫ��A�ӥ���{�ɬ���w�P�V�W�L140�H�A�ɭP�Y�����e�f�ΰ��P�R�ʡC�b�D�`�j�������H���H�f���S����H5N1�����f�r���K�̯�O�C�Y�Ȭw�@�tH5N1�A�q�L�v�B�A���λP�w�A���H�����f�r���աA�q�Ө��o���ĤΫ���b�H�����Ǽ����S�ʡA�ڭ̱N�|���{�s���y��f���X�{
(Guan 2004)�C�b�պޤ��w�ҩ��A�b�Ȭw�@�t���P�f�ʸV�y�PH5N1��HA�J�ժ����鵲�X���I����خ��Ī��P�ɥ洫
(Q226L and G228S) �|�ϻP2-6�����H�����骺���X�̦��Ħa�i��A�p��L�w�A���H�����ҫ��y�P�f�r�@��
(Harvey 2004)�CGambaryan ���H (2006) �g�w�ѧO�X���ۤ@��2003�~�P�VH5N1�����l����ӤH���j�����A�ӳo�P��L�Ҧ��ӦۤH���γ�����H5N1�j�����ۤϡA��ܥX��2-6���馳�������˩M�O�A�o�O�ѩ�bHA1���鵲�X���I���W�S��S227N���ܡC
�o�Ҥl�i��b�\Ū�o�峹�ɥu�O�Y�N���{�Ϊ̤w�g�o�� �w �S���H�i�H���D�ιw���C�o�بƥ�o�ͪ����|�O�����P�a�V���Ǽ����f�r�ƶq�A�q�ӻP�H�����S�䤤�����I�����C�ҥH�A�bH5N1���ڷ��P��i����୰�C�f�r�y�����y��f���I�C���ݦa�A�b���p���l��ΰQ�װϤw��ij�A�u�ݰʥέp���@�������a�V��H5N�ӵo�iH5�S���H���̭]��������ʤ����Q�A�|�K�H����H5N1�y��f�¯٦Ӷi�汵�ئ���j���ĪG�C
�۱qH5N1�b1997�~�����ѤH���j���X�ӡA�������৹����H���J�D���ͬy��f�o�̫�B�J�C�M�ӡA�������s���X�A�b�Ʀ~���AH5N1��������ʪ����r�ʴ����F�A�ӱJ�D�����O���X�j�F:
1. 1999��2002�~�j���ۤ��ꤺ�a�A�H�αq2003�~�j���۶V�n�����㰷�d���a�n��H5N1�A�w�麥�ܱo��������ʪ������r��
(Chen
2004)�C
2. H5N1�w�X�j�F�����J�D���O�A�۵M�a�P�V�α����H�e�{�����ܸV�y�P�f�r�P�V��������
(�ߡA�Ѫ�) (http://www.who.int/csr/don/2004_02_20/en/
index.html)�C
���O�A�b�`���ȬwH5N1���p���P�ɡA����������L�i���j�ɭP�y��f��O���y�P�f�r�����|�X�{�Τw�g�X�{�C�Ҧp�A�b1980�~�Τ��e�b�Ȭw�䤣�쪺H9N2�ȫ��~�ءA�b�Ȭw���a�V�s�������w�ܱo���M�A�ӥB�w���Ħa�P����F�ΪF�n�����s����
(Shortridge 1992, Peiris
2001, Xu 2004)�C�o�ǯf�r��������ܥX�����A���H�����f�r���S���� (Li
2005b, Matrosovich 2001)�C�o��H9�f�r���ܼs�x���J�D���O�A�b��]�譱�۷��h�ˤơA�H�ίઽ���P�V�H���CH9N2�~�ءA�Y�ɭP�b����o�ǤH���P�V�Ӯת���]�A����ܥX�P1997�~��H5N1�f�r�۪�]��
(Lin
2000)�C
����
�b�L�h�Q�~�A���P�f�ʸV�y�P (avian influenza, AI) �@���a�V���}�a�ʯe�f�����n�ʸg�w��ۦa�W�ɡC�C�P�f��
(low pathogenicity, LP) H5��H7�ȫ����V�y�P�f�r�ѳ��ͤ����x�w���ǤJ�O�o�ӹL�{����¦�C�{�b�|�ݻ����C�P�f��H5��H7�b���x�w��������O�_���b���ܡA�H�Ψ���ܪ��]�ѡC���Y��F�n�Ȯa�V�s���Ȭw�@�t���P�f�ʸV�y�PH5N1���a��ʪ��A�ӹ�E�p�����s�ް_�W�c�����X�A���E�p�����s���a��ʡA���P�f�ʸV�y�P�y��f�Ǫ������ಾ���G�Q���G���C�o�|���j���W�Ҫ��a�V�~�����j���v�T�C�H�����S��f�r�����I�O�����P�a�V���W�[��b�ʰʪ��H���f�r���s�b�����C
�A�Ψ쳾�����~��譱�����p�A���ܦh���D���M���Q�ѵ�:
1. �b���ͤξE�p�����s���A�Ȭw�@�t���P�f�ʸV�y�PH5N1�O�_�w�إߥX�y��f�����A?
2. ���P�f�ʸV�y�P�f�r��_�b�����~�ضi�Ʀ���r�ͪ����A�ӫO�d��a�V���r��?
3. ���a�ʪ��O�_�ﰪ�P�f�ʸV�y�P�f�r���Ǽ�����@��?
4. �ѽX�@HA�J�ժ����J�հŤ����I���ǦC�d��A�O�_�u�bH5��H7�ȫ��ɦV����� ?
5. �b�Ȭw�A�����H5N1���a�V�j�q���ت��v�T�N�|���? ����f�r�X���άO�[�t�ܭ��Ʋ��ΰk��?
6. �C�P�f�ʸV�y�P�ȫ�H5��H7�b�ѵM�x�w�����檺�ಾ�|�_�]���i��v�T��i�ư��������p?
�S�O�O�Ĥ@�Ӱ��D�A�������˩ʪ����n�� �w �ӳo�ä������~��譱�C�Ȭw�@�t���P�f�ʸV�y�PH5N1�b�E�p���������a��ʡA�|���a�V�O���a�a�ӫ��¯١C���X�o�n�D���]�A�b�a�V�O���a�T��ۥѺ��C���Y�檺�ͪ��w�����I�J��C�@����ܡA��n�Ҽ{�a�V���j�q���ءC�@���ĤG�ӳ~�|�A���ͳ������a��ʡA�γ\�]�i�ɭP���P�f�ʸV�y�PH5N1�f�r�b�۵M����
(��A������) ���s�b�A�H�Υi��a�ӤH�����S��f�r����b���B�~���I�C��ثe����A�S�����i��ܦ��q�����Φ۵M���ҷ��Y�P�V�H���C�Ҧ����G�F���H���P�V�A�]�A�̪�Ӧۤg�ը䪺�A���G�O�Ѯa�V�����f�r�X�W�λP�a�V��K��IJ�Ө��o�C�{�ɦb���������y�檺�ʪ��H�����P�f�ʸV�y�PH5N1�f�r�A������ʤμ�b���v�T�A�ݭn��Ǯa�B�F�v�a�Τ������w����ij���ԷV����ʡC
|
|
���
- Allan
WH, Alexander DJ, Pomeroy BS, Parsons G.
Use of virulence index tests for avian influenza
viruses. Avian Dis 1977; 21: 359-63. Abstract:
http://amedeo.com/lit.php?id=907578
- Amonsin
A, Payungporn S, Theamboonlers A, et al.
Genetic characterization of H5N1 influenza
A viruses isolated from zoo tigers in Thailand.
Virology 2005; Sep 26; [Epub ahead of print]
Abstract: http://amedeo.com/lit.php?id=16194557
- Banks
J, Speidel ES, Moore E, Plowright L, Piccirillo
A, Capua I, Cordioli P, fioretti A, Alexander
DJ. Changes in the haemagglutinin and the
neuraminidase genes prior to the emergence
of highly pathogenic H7N1 avian influenza
viruses in Italy. Arch Virol. 2001;146:
963-73. Abstract: http://amedeo.com/lit.php?id=11448033
- Bano
S, Naeem K, Malik SA. Evaluation of pathogenic
potential of avian influenzavirus serotype
H9N2 in chicken. Avian Dis 2003; 47: Suppl:
817-22. Abstract: http://amedeo.com/lit.php?id=14575070
- Beard
CW, Schnitzlein WM, Tripathy DN. Protection
of chicken against highly pathogenic avian
influenzavirus (H5N2) by recombinant fowlpox
viruses. Avian Dis 1991; 35: 356-9. Abstract:
http://amedeo.com/lit.php?id=1649592
- Beck
JR, Swayne DE, Davison S, Casavant S, Gutierrez
C. Validation of egg yolk antibody testing
as a method to determine influenza status
in white leghorn hens. Avian Dis 2003; 47:
Suppl: 1196-9. Abstract: http://amedeo.com/lit.php?id=14575141
- Belshe
RB. The origins of pandemic influenza--lessons
from the 1918 virus. N Engl J Med. 2005;
353: 2209-11.
- Brown
IH, Harris PA, McCauley JW, Alexander DJ.
Multiple genetic reassortment of avian and
human influenza A viruses in european pigs,
resulting in the emergence of an H1N2 virus
of novel genotype. J Gen Virol 1998; 79:
2947-2955. Abstract: http://amedeo.com/lit.php?id=9880008
- Brown
IH, Hill ML, Harris PA, Alexander DJ, McCauley
JW. Genetic characterisation of an influenza
A virus of unusual subtype (H1N7) isolated
from pigs in England. Arch Virol 1997; 142:
1045-50. Abstract: http://amedeo.com/lit.php?id=9191869
- Bulaga
LL, Garber L, Senne DA, et al. Epidemiologic
and surveillance studies on avian influenza
in live-bird markets in New York and New
Jersey, 2001. Avian Dis 2003; 47: Suppl:
996-1001. Abstract: http://amedeo.com/lit.php?id=14575100
- Butt
KM, Smith GJ, Chen H, Zhang LJ, Leung YH,
Xu KM, Lim W, Webster RG, Yuen KY, Peiris
JS, Guan Y. Human infection with an avian
H9N2 influenza A virus in Hong Kong in 2003.
J Clin Microbiol. 2005 Nov;43(11):5760-7.
Abstract: http://amedeo.com/lit.php?id=16272514
- Capua
I, Mutinelli F. Low pathogenicity (LPAI)
and highly pathogenic (HPAI) avian influenza
in turkeys and chicken. In: Capua I, Mutinelli
F. (eds.), A Colour Atlas and Text on Avian
Influenza, Papi Editore, Bologna, 2001,
pp. 13-20
- Capua
I, Mutinelli F, Marangon S, Alexander DJ.
H7N1 avian influenza in Italy (1999-2000)
in intensively reared chicken and turkeys.
Av Pathol 2000; 29: 537-43
- Cattoli
G, Terregino C, Brasola V, Rodriguez JF,
Capua I. Development and preliminary validation
of an ad hoc N1-N3 discriminatory test for
the control of avian influenza in Italy.
Avian Dis 2003; 47: Suppl: 1060-2. Abstract:
http://amedeo.com/lit.php?id=14575111
- Cattoli
G, Drago A, Maniero S, Toffan A, Bertoli
E, Fassina S, Terregino C, Robbi C, Vicenzoni
G, Capua I. Comparison of three rapid detection
systems for type A influenza virus on tracheal
swabs of experimentally and naturally infected
birds. Avian Pathol 2004; 33: 432-7. Abstract:
http://amedeo.com/lit.php?id=15370041
- Cauthen
AN, Swayne DE, Schultz-Cherry S, Perdue
ML, Suarez DL. Continued circulation in
China of highly pathogenic avian influenza
viruses encoding the hemagglutinin gene
associated with the 1997 H5N1 outbreak in
poultry and humans. J Virol 2000; 74: 6592-9.
Abstract: http://amedeo.com/lit.php?id=10864673
- Full text http://jvi.asm.org/cgi/content/full/74/14/6592
- Centanni
E, Savonuzzi O, cited by Stubbs E.L.: "Fowl
plague." Diseases of Poultry. 4th ed.; 1965.
- Chen
J, Lee KH, Steinhauer DA, Stevens DJ, Skehel
JJ, Wiley DC. Structure of the hemagglutinin
precursor cleavage site, a determinant of
influenza pathogenicity and the origin of
the labile conformation. Cell 1998; 95:
409-17. Abstract: http://amedeo.com/lit.php?id=9814710
- Chen
H, Smith GJ, Zhang SY, Qin K, Wang J, Li
KS, Webster RG, Peiris JS, Guan Y. Avian
flu: H5N1 virus outbreak in migratory waterfowl.
Nature 2005; 436: 191-2. Abstract: http://amedeo.com/lit.php?id=16007072
- Cheung
CY, Poon LL, Lau AS, Luk W, Lau YL, Shortridge
KF, Gordon S, Guan Y, Peiris JS. Induction
of proinflammatory cytokines in human macrophages
by influenza A (H5N1) viruses: a mechanism
for the unusual severity of human disease?
Lancet 2002; 360: 1831-7. Abstract: http://amedeo.com/lit.php?id=12480361
- Choi
YK, Nguyen TD, Ozaki H, Webby RJ, Puthavathana
P, Buranathal C, Chaisingh A, Auewarakul
P, Hanh NT, Ma SK, Hui PY, Guan Y, Peiris
JS, Webster RG. Studies of H5N1 influenza
virus infection of pigs by using viruses
isolated in Viet Nam and Thailand in 2004.
J Virol 2005; 79: 10821-5 16051873
- Claas
EC, Osterhaus AD, van Beek R, et al. Human
influenza A H5N1 virus related to a highly
pathogenic avian influenza virus. Lancet
1998; 351: 472-7. Abstract: http://amedeo.com/lit.php?id=9482438
- Collins
RA, Ko LS, So KL, Ellis T, Lau LT, Yu AC.
Detection of highly pathogenic and low pathogenic
avian influenza subtype H5 (EurAsian lineage)
using NASBA. J Virol Methods 2002; 103:
213-25. Abstract: http://amedeo.com/lit.php?id=12008015
- Crawford
J, Wilkinson B, Vosnesensky A, et al. Baculovirus-derived
hemagglutinin vaccines protect against lethal
influenza infections by avian H5 and H7
subtypes. Vaccine 1999; 17: 2265-74. Abstract:
http://amedeo.com/lit.php?id=10403594
- Davison
S, Ziegler AF, Eckroade RJ. Comparison of
an antigen-capture enzyme immunoassay with
virus isolation for avian influenza from
flied samples. Avian Dis. 1998; 42: 791-5.
Abstract: http://amedeo.com/lit.php?id=9876850
- Du
Ry van Beest Holle M, Meijer A, Koopmans
M, de Jager C. Human-to-human transmission
of avian influenza A/H7N7, The Netherlands,
2003. Euro Surveill 2005; 10 [Epub ahead
of print]. Abstract: http://amedeo.com/lit.php?id=16371696
- Dybkaer
K, Munch M, Handberg KJ, Jorgensen PH. Application
and evaluation of RT-PCR-ELISA for the nucleoprotein
and RT-PCR for detection of low-pathogenic
H5 and H7 subtypes of avian influenza virus.
J Vet Diagn Invest 2004; 16: 51-6. Abstract:
http://amedeo.com/lit.php?id=14974847
- Elbers
AR, Kamps B, Koch G. Performance of gross
lesions at postmortem for the detection
of outbreaks during the avian influenza
A virus (H7N7) epidemic in The Netherlands
in 2003. Avian Pathol 2004; 33: 418-22.
Abstract: http://amedeo.com/lit.php?id=15370039
- Elbers
AR, Koch G, Bouma A. Performance of clinical
signs in poultry for the detection of outbreaks
during the avian influenza A (H7N7) epidemic
in The Netherlands in 2003. Avian Pathol
2005; 34: 181-7. Abstract: http://amedeo.com/lit.php?id=16191700
- Fouchier
RA, Bestebroer TM, Herfst S, Van Der Kemp
L, Rimmelzwaan GF, Osterhaus AD. Detection
of influenza A viruses from different species
by PCR amplification of conserved
sequences in the matrix gene. J Clin Microbiol
2000; 38: 4096-101. Abstract: http://amedeo.com/lit.php?id=11060074
- Fouchier
RA, Olsen B, Bestebroer TM, et al. Influenza
A virus surveillance in wild birds in Northern
Europe in 1999 and 2000. Avian Dis 2003;
47: Suppl: 857-60. Abstract: http://amedeo.com/lit.php?id=14575077
- Fouchier
RA, Schneeberger PM, Rozendaal FW, Broekman
JM, Kemink SA, Munster V, Kuiken T, Rimmelzwaan
GF, Schutten M, Van Doornum GJ, Koch G,
Bosman A, Koopmans M, Osterhaus AD. Avian
influenza A virus (H7N7) associated with
human conjunctivitis and a fatal case of
acute respiratory distress syndrome. Proc
Natl Acad Sci U S A 2004; 101: 1356-61.
Abstract: http://amedeo.com/lit.php?id=14745020
- Full text at http://www.pnas.org/cgi/content/full/101/5/1356
- Fouchier
RA, Munster V, Wallensten A, et al. Characterization
of a novel influenza A virus hemagglutinin
subtype (H16) obtained from black-headed
gulls. J Virol 2005; 79: 2814-22. Abstract:
http://amedeo.com/lit.php?id=15709000
- Gabriel
G, Dauber B, Wolff T, Planz O, Klenk HD,
Stech J. The viral polymerase mediates adaptation
of an avian influenza virus to a mammalian
host. Proc Natl Acad Sci U S A 2005; 102:
18590-5. Abstract:
http://amedeo.com/lit.php?id=16339318
- Gambaryan
AS, Tuzikov AB, Pazynina GV, Webster RG,
Matrosovich MN, Bovin NV. H5N1 chicken influenza
viruses display a high binding affinity
for Neu5Acalpha2-3Galbeta1-4(6-HSO3)GlcNAc-containing
receptors. Virology. 2004; 326: 310-6.
- Gambaryan
A, Yamnikova S, Lvov D, et al. Receptor
specificity of influenza viruses from birds
and mammals: new data on involvement of
the inner fragments of the carbohydrate
chain. Virology 2005; 334: 276-83. Abstract:
http://amedeo.com/lit.php?id=15780877
- Gambaryan
A, Tuzikov A, Pazynina G, Bovin N, Balish
A, Klimov A. Evolution of the receptor binding
phenotype of influenza A (H5) viruses. Virology
2006; 344: 432-8. Abstract: http://amedeo.com/lit.php?id=16226289
- Garcia
M, Crawford JM, Latimer JW, Rivera-Cruz
E, Perdue ML. Heterogeneity in the hemagglutinin
gene and emergence of the highly pathogenic
phenotype among recent H5N2 avian influenza
viruses from Mexico. J Gen Virol 1996; 77:
1493-504. Abstract: http://amedeo.com/lit.php?id=8757992
- Garcia
A, Johnson H, Srivastava DK, Jayawardene
DA, Wehr DR, Webster RG. Efficacy of inactivated
H5N2 influenza vaccines against lethal A/Chicken/Queretaro/19/95
infection. Avian Dis 1998; 42: 248-56. Abstract:
http://amedeo.com/lit.php?id=9645315
- Giannecchini
S, Campitelli L, Calzoletti L, De Marco
MA, Azzi A, Donatelli I. Comparison
of in vitro replication features of H7N3
influenza viruses from wild ducks and turkeys:
potential implications for interspecies
transmission. J Gen Virol 2006; 87: 171-5.
Abstract: http://amedeo.com/lit.php?id=16361429
- Gorman
OT, Bean WJ, Webster RG. Evolutionary processes
in influenza viruses: divergence, rapid
evolution, and stasis. Curr Top Microbiol
Immunol 1992; 176: 75-97. Abstract: http://amedeo.com/lit.php?id=1600756
- Govorkova
EA, Rehg JE, Krauss S, Yen HL, Guan Y, Peiris
M, Nguyen TM, Hanh TH, Puthavathana P, Long
HT, Buranathai C, Lim W, Webster RG, Hoffmann
E. Lethality to ferrets of H5N1 influenza
viruses isolated from humans and poultry
in 2004. J Virol 2005; 79: 2191-2198. Abstract:
http://amedeo.com/lit.php?id=15681421
- Guan
Y, Peiris JS, Poon LL, et al. Reassortants
of H5N1 influenza viruses recently isolated
from aquatic poultry in Hong Kong SAR. Avian
Dis 2003; 47: Suppl: 911-3. Abstract: http://amedeo.com/lit.php?id=14575085
- Guan
Y, Peiris M, Kong KF, et al. H5N1 influenza
viruses isolated from geese in Southeastern
China: evidence for genetic reassortment
and interspecies transmission to ducks.
Virology 2002b; 292: 16-23. Abstract: http://amedeo.com/lit.php?id=11878904
- Guan
Y, Poon LL, Cheung CY, Ellis TM, Lim W,
Lipatov AS, Chan KH, Sturm-Ramirez KM, Cheung
CL, Leung YH, Yuen KY, Webster RG, Peiris
JS. H5N1 influenza: a protean pandemic threat.
Proc Natl Acad Sci U S A 2004; 101: 8156-61.
Abstract: http://amedeo.com/lit.php?id=15148370
- Full text at http://www.pnas.org/cgi/content/full/101/21/8156
- Guo
Y, Wang M, Kawaoka Y, Gorman O, Ito T, Saito
T, Webster RG. Characterization of a new
avian-like influenza A virus from horses
in China. Virology 1992; 188: 245-55. Abstract:
http://amedeo.com/lit.php?id=1314452
- Haque
ME, Koppaka V, Axelsen PH, Lentz BR. Properties
and Structures of the Influenza and HIV
Fusion Peptides on Lipid Membranes: Implications
for a Role in Fusion. Biophys J. 2005; 89:3183-94.
Abstract: http://amedeo.com/lit.php?id=16183890
- Hatta
M, Gao P, Halfmann P, Kawaoka Y. Molecular
basis for high virulence of Hong Kong H5N1
influenza A viruses. 2001; Science 293:
1840-1842. Abstract: http://amedeo.com/lit.php?id=11546875
- Hayden
F, Croisier A. Transmission of avian influenza
viruses to and between humans. J Infect
Dis 2005;192: 1311-4.
- Henzler
DJ, Kradel DC, Davison S, et al. Epidemiology,
production losses, and control measures
associated with an outbreak of avian influenza
subtype H7N2 in Pennsylvania (1996-98).
Avian Dis 2003; 47: Suppl: 1022-36. Abstract:
http://amedeo.com/lit.php?id=14575105
- Herrler
G, Hausmann J, Klenk HD. Sialic acid as
receptor determinant of ortho- and paramyxoviruses.
In: Rosenberg A (ed), Biology of the Sialic
Acids, Plenum Press NY, 1995: p. 315-336
- Horimoto
T, Kawaoka Y. Molecular changes in virulent
mutants arising from avirulent avian influenza
viruses during replication in 14-day-old
embryonated eggs. Virology 1995; 206: 755-9.
Abstract: http://amedeo.com/lit.php?id=7831837
- Hulse-Post
DJ, Sturm-Ramirez KM, Humberd J, et al.
Role of domestic ducks in the propagation
and biological evolution of highly pathogenic
H5N1 influenza viruses in Asia. Proc Natl
Acad Sci U S A 2005; 102: 10682-7. Abstract:
http://amedeo.com/lit.php?id=16030144
- Ito
T, Kawaoka Y, Nomura A, Otsuki K. Receptor
specificity of influenza A viruses from
sea mammals correlates with lung sialyloligosaccharides
in these animals. J Vet Med Sci 1999; 61:
955-8. Abstract: http://amedeo.com/lit.php?id=10487239
- Ito
T, Okazaki K, Kawaoka Y, Takada A, Webster
RG, Kida H (1995). Perpetuation of influenza
A viruses in Alaskan waterfowl reservoirs.
Arch.Virol. 140, 1163-1172. Abstract: http://amedeo.com/lit.php?id=7646350
- Jin
M, Wang G, Zhang R, Zhao S, Li H, Tan Y,
Chen H. Development of enzyme-linked
immunosorbent assay with nucleoprotein as
antigen for detection of antibodies to avian
influenza virus. Avian Dis 2004; 48: 870-8.
Abstract: http://amedeo.com/lit.php?id=15666868
- Jones
YL, Swayne DE. Comparative pathobiology
of low and high pathogenicity H7N3 Chilean
avian influenza viruses in chicken. Avian
Dis 2004; 48: 119-28. Abstract: http://amedeo.com/lit.php?id=15077805
- Karasin
AI, Brown IH, Carman S, Olsen CW. Isolation
and characterization of H4N6 avian influenza
viruses from pigs with pneumonia in Canada.
J Virol 2000; 74: 9322-7. Abstract: http://amedeo.com/lit.php?id=10982381
-
Kawaoka Y, Naeve CW, Webster RG. Is virulence
of H5N2 influenza viruses in chicken associated
with loss of carbohydrate from the hemagglutinin?
Virology 1984; 139: 303-16. Abstract: http://amedeo.com/lit.php?id=6516214
- Kessler
N, Ferraris O, Palmer K, Marsh W, Steel
A. Use of the DNA flow-thru chip, a three-dimensional
biochip, for typing and subtyping of influenza
viruses. J Clin Microbiol. 2004; 42: 2173-85.
Abstract: http://amedeo.com/lit.php?id=15131186
- Kim
JA, Ryu SY, Seo SH. Cells in the respiratory
and intestinal tracts of chicken have different
proportions of both human and avian influenza
virus receptors. J Microbiol 2005; 43: 366-9.
Abstract: http://amedeo.com/lit.php?id=16145552
- Klempner
MS, Shapiro DS. Crossing the species barrier
- one small step to man, one giant leap
to mankind. N Engl J Med 2004; 350: 1171-2.
Epub 2004 Feb 25. http://amedeo.com/lit.php?id=14985471
- Klopfleisch
R, Werner O, Mundt E,
Harder T, Teifke JP. Neurotropism
of highly pathogenic avian influenzavirus
A/chicken/Indonesia/2003 (H5N1) in experimentally
infected pigeons (Columbia livia f. domestica).
Vet Pathol 2006; in press
- Koopmans
M, Wilbrink B, Conyn M, et al. Transmission
of H7N7 avian influenza A virus to human
beings during a large outbreak in commercial
poultry farms in the Netherlands. Lancet
2004; 363: 587-93. Abstract: http://amedeo.com/lit.php?id=14987882
- Krauss
S, Walker D, Pryor SP, Niles L, Chenghong
L, Hinshaw VS, Webster RG. Influenza A viruses
of migrating wild aquatic birds in North
America. Vector Borne Zoonotic Dis 2004;
4: 177-89. Abstract: http://amedeo.com/lit.php?id=15631061
- Kwon
YK, Joh SJ, Kim MC, Sung HW, Lee YJ, Choi
JG, Lee EK, Kim JH. Highly pathogenic avian
influenza (H5N1) in the commercial domestic
ducks of South Korea. Avian Pathol 2005;
34: 367-70. Abstract: http://amedeo.com/lit.php?id=16147575
- Landman
WJ, Schrier CC. Avian influenza: eradication
from commercial poultry is still not in
sight. Tijdschr. Diergeneeskd 2004; 129:
782-96. Abstract: http://amedeo.com/lit.php?id=15624878
- Lee
CW, Suarez DL. Application of real-time
RT-PCR for the quantitation and competitive
replication study of H5 and H7 subtype avian
influenza virus. J Virol Methods. 2004;
119: 151-8. Abstract: http://amedeo.com/lit.php?id=15158597
- Lee
CW, Swayne DE, Linares JA, Senne DA, Suarez
DL. H5N2 avian influenza outbreak in Texas
in 2004: the first highly pathogenic strain
in the United States in 20 years? J Virol
2005; 79: 11412-21. Abstract: http://amedeo.com/lit.php?id=16103192
- Lee
CW, Senne DA, Suarez DL. Generation of reassortant
influenza vaccines by reverse genetics that
allows utilization of a DIVA (Differentiating
Infected from Vaccinated Animals) strategy
for the control of avian influenza. Vaccine
2004; 22: 3175-81. Abstract: http://amedeo.com/lit.php?id=15297071
- Li
J, Chen S, Evans DH. Typing and subtyping
influenza virus using DNA microarrays and
multiplex reverse transcriptase PCR. J Clin
Microbiol. 2001; 39: 696-704. Abstract:
http://amedeo.com/lit.php?id=11158130
- Li
KS, Guan Y, Wang J, et al. Genesis of a
highly pathogenic and potentially pandemic
H5N1 influenza virus in eastern Asia. Nature
2004; 430: 209-13. Abstract: http://amedeo.com/lit.php?id=15241415
- Li
C, Yu K, Tian G, Yu D, Liu L, Jing B, Ping
J, Chen H. Evolution of H9N2 influenza
viruses from domestic poultry in Mainland
China. Virology 2005b; 340: 70-83. Abstract:
http://amedeo.com/lit.php?id=16026813
- Li
Z, Chen H, Jiao P, Deng G, Tian G, Li Y,
Hoffmann E, Webster RG, Matsuoka Y, Yu K
. Molecular basis of replication of duck
H5N1 influenza viruses in a mammalian mouse
model. 2005a; J Virol 79; 12058-12064. Abstract:
http://amedeo.com/lit.php?id=16140781
- Lin
YP, Shaw M, Gregory V, Cameron K, Lim W,
Klimov A, Subbarao K, Guan Y, Krauss S,
Shortridge K, Webster R, Cox N, Hay A. Avian-to-human
transmission of H9N2 subtype influenza A
viruses: relationship between H9N2 and H5N1
human isolates. Proc Natl Acad Sci U S A.
2000; 97: 9654-8. Abstract: http://amedeo.com/lit.php?id=10920197
- Full text at http://www.pnas.org/cgi/content/full/97/17/9654
- Liu
M, Wood JM, Ellis T, Krauss S, Seiler P,
Johnson C, Hoffmann E, Humberd J, Hulse
D, Zhang Y, Webster RG, Perez DR. Preparation
of a standardized, efficacious agricultural
H5N3 vaccine by reverse genetics. Virology.
2003; 314: 580-90. Abstract: http://amedeo.com/lit.php?id=14554086
- Lu
H, Castro AE, Pennick K, Liu J, Yang Q,
Dunn P, Weinstock D, Henzler D. Survival
of avian influenza virus H7N2 in SPF chickens
and their environments. Avian Dis. 2003;
47: 1015-21. Abstract: http://amedeo.com/lit.php?id=14575104
- Luschow
D, Werner O, Mettenleiter TC, Fuchs W. Vaccination
with infectious laryngotracheitis virus
recombinants expressing the hemagglutinin
(H5) gene. Vaccine. 2001 Jul 20;19(30):4249-59.
http://amedeo.com/lit.php?id=11457552
- Maines
TR, Lu XH, Erb SM, et al. Avian influenza
(H5N1) viruses isolated from humans in Asia
in 2004 exhibit increased virulence in mammals.
J Virol 2005; 79: 11788-800. Abstract: http://amedeo.com/lit.php?id=16140756
- Mannelli
A, Ferre N, Marangon S. Analysis of the
1999-2000 highly pathogenic avian influenza
(H7N1) epidemic in the main poultry-production
area in northern Italy. Prev Vet Med. 2005
Oct 19; [Epub ahead of print]. Abstract:
http://amedeo.com/lit.php?id=16243405
- Marangon
S, Capua I, Pozza G, Santucci U. Field experiences
in the control of avian influenza outbreaks
in densely populated poultry areas. Dev
Biol (Basel) 2004; 119: 155-64. Abstract:
http://amedeo.com/lit.php?id=15742627
- Marangon
S, Capua I. Control of AI in Italy: from
"Stamping-out"-strategy to emergency
and prophylactic vaccination. In: Proc.
Internat. Conf on Avian Influenza Paris
2005; O.I.E., p. 29.
- Matrosovich
MN, Krauss S, Webster RG. H9N2 influenza
A viruses from poultry in Asia have human
virus-like receptor specificity. Virology
2001; 281: 156-62. Abstract: http://amedeo.com/lit.php?id=11277689
- Meulemans
G, Carlier MC, Gonze M, Petit P. Comparison
of hemagglutination-inhibition, agar gel
precipitin, and enzyme-linked immunosorbent
assay for measuring antibodies against influenza
viruses in chicken. Avian Dis 1987; 31:
560-3. Abstract: http://amedeo.com/lit.php?id=2960313
- Mo
IP, Brugh M, fletcher OJ, Rowland GN, Swayne
DE. Comparative pathology of chicken experimentally
inoculated with avian influenza viruses
of low and high pathogenicity. Avian Dis
1997; 41: 125-36. Abstract: http://amedeo.com/lit.php?id=9087329
- Mutinelli
F, Capua I, Terregino C, Cattoli G. Clinical,
gross, and microscopic findings in different
avian species naturally infected during
the H7N1 low- and high-pathogenicity avian
influenza epidemics in Italy during 1999
and 2000. Avian Dis 2003a; 47: Suppl: 844-8.
Abstract: http://amedeo.com/lit.php?id=14575075
- Mutinelli
F, Hablovarid H, Capua I. Avian embryo susceptibility
to Italian H7N1 avian influenza viruses
belonging to different lineages. Avian Dis
2003b; 47: Suppl: 1145-9. Abstract: http://amedeo.com/lit.php?id=14575131
- Nakatani
H, Nakamura K, Yamamoto Y, Yamada M, Yamamoto
Y. Epidemiology, pathology, and immunohistochemistry
of layer hens naturally affected with H5N1
highly pathogenic avian influenza in Japan.
Avian Dis 2005; 49: 436-41. Abstract: http://amedeo.com/lit.php?id=16252503
- Neumann
G, Brownlee GG, Fodor E, Kawaoka Y. Orthomyxovirus
replication, transcription, and polyadenylation.
Curr Top Microbiol Immunol 2004; 283: 121-43.
Abstract: http://amedeo.com/lit.php?id=15298169
- Nestorowicz
A, Kawaoka Y, Bean WJ, Webster RG. Molecular
analysis of the hemagglutinin genes of Australian
H7N7 influenza viruses: role of passerine
birds in maintenance or transmission? Virology
1987; 160: 411-8. Abstract: http://amedeo.com/lit.php?id=3660587
- Okazaki
K, Takada A, Ito T, et al. Precursor genes
of future pandemic influenza viruses are
perpetuated in ducks nesting in Siberia.
Arch Virol 2000; 145: 885-93. Abstract:
http://amedeo.com/lit.php?id=10881676
- Pasick
J, Handel K, Robinson J, et al. Intersegmental
recombination between the hemagglutinin
and matrix genes was responsible for the
emergence of a highly pathogenic H7N3 avian
influenza virus in British Columbia. J Gen
Virol 2005; 86: 727-31. Abstract: http://amedeo.com/lit.php?id=15722533
- Payungporn
S, Phakdeewirot P, Chutinimitkul S, Theamboonlers
A, Keawcharoen J, Oraveerakul K, Amonsin
A, Poovorawan Y. Single-step multiplex reverse
transcription-polymerase chain reaction
(RT-PCR) for influenza A virus subtype H5N1
detection. Viral Immunol 2004; 17: 588-93.
Abstract: http://amedeo.com/lit.php?id=15671756
- Perdue
ML, Garcia M, Senne D, Fraire M. Virulence-associated
sequence duplication at the hemagglutinin
cleavage site of avian influenza viruses.
Virus Res 1997; 49: 173-86. Abstract: http://amedeo.com/lit.php?id=9213392
- Perdue
ML, Suarez DL. Structural features of the
avian influenza virus hemagglutinin that
influence virulence. Vet Microbiol 2000;
74: 77-86. Abstract: http://amedeo.com/lit.php?id=10799780
- Perkins
LE, Swayne DE. Pathogenicity of a Hong Kong-origin
H5N1 highly pathogenic avian influenza virus
for emus, geese, ducks, and pigeons. Avian
Dis 2002a; 46: 53-63. Abstract: http://amedeo.com/lit.php?id=11924603
- Perkins
LE, Swayne DE. Susceptibility of laughing
gulls (Larus atricilla) to H5N1 and
H5N3 highly pathogenic avian influenza viruses.
Avian Dis 2002b; 46: 877-85. Abstract: http://amedeo.com/lit.php?id=12495048
- Perkins
LE, Swayne DE. Comparative susceptibility
of selected avian and mammalian species
to a Hong Kong-origin H5N1 high-pathogenicity
avian influenza virus. Avian Dis. 2003;47(3
Suppl):956-67. Abstract: http://amedeo.com/lit.php?id=14575094
- Perroncito
CE. [it. Typhoid epizootic in gallinaceous
birds.] Epizoozia tifoide nei gallinacei.
Torino: Annali Accademia Agricoltura 1878;
21:87-126.
- Phipps
LP, Essen SC, Brown IH. Genetic subtyping
of influenza A viruses using RT-PCR with
a single set of primers based on conserved
sequences within the HA2 coding region.
J Virol Methods 2004;122:119-22. Abstract:
http://amedeo.com/lit.php?id=15488629
- Rohm
C, Horimoto T, Kawaoka Y, Suss J, Webster
RG. Do hemagglutinin genes of highly pathogenic
avian influenza viruses constitute unique
phylogenetic lineages? Virology 1995; 209:
664-70. Abstract: http://amedeo.com/lit.php?id=7778300
- Rott
R, Orlich M, Scholtissek C. Correlation
of pathogenicity and gene constellation
of influenza A viruses. III. Non-pathogenic
recombinants derived from highly pathogenic
parent strains. J Gen Virol 1979; 44: 471-7.
Abstract: http://amedeo.com/lit.php?id=521799
- Rott
R, Klenk HD, Nagai Y, Tashiro M. Influenza
viruses, cell enzymes, and pathogenicity.
Am J Respir Crit Care Med. 1995; 152: S16-9.
Abstract: http://amedeo.com/lit.php?id=7551406
- Rust
MJ, Lakadamyali M, Zhang F, Zhuang X. Assembly
of endocytic machinery around individual
influenza viruses during viral entry. Nat
Struct Mol Biol 2004; 11: 567-73. Abstract:
http://amedeo.com/lit.php?id=15122347
- Sala
G, Cordioli P, Moreno-Martin A, et al. ELISA
test for the detection of influenza H7 antibodies
in avian sera. Avian Dis 2003; 47: Suppl:
1057-9. Abstract: http://amedeo.com/lit.php?id=14575110
- Schäfer
W. Vergleichende sero-immunologische Untersuchungen
über die Viren der Influenza und klassischen
Geflügelpest. Zeitschr Naturforschung
1955; 10b: 81-91
- Scholtissek
C, Hinshaw VS, Olsen CW. Influenza in pigs
and their role as the intermediate host.
In: Nicholson KG, Webster RG, Hay AJ (eds.),
Textbook of Influenza, Blackwell Scientific,
Oxford, 1998; p 137-145
- Selleck
PW, Lowther SL, Russell GM, Hooper PT. Rapid
diagnosis of highly pathogenic avian influenza
using pancreatic impression smears. Avian
Dis 2003; 47 (3 Suppl): 1190-5. Abstract:
http://amedeo.com/lit.php?id=14575140
- Senne
DA, Panigrahy B, Kawaoka Y, et al. Survey
of the hemagglutinin (HA) cleavage site
sequence of H5 and H7 avian influenza viruses:
amino acid sequence at the HA cleavage site
as a marker of pathogenicity potential.
Avian Dis 1996; 40: 425-37. Abstract: http://amedeo.com/lit.php?id=8790895
- Seo
SH, Hoffmann E, Webster RG. The NS1 gene
of H5N1 influenza viruses circumvents the
host anti-viral cytokine responses. Virus
Res 2004; 103: 107-13. Abstract: http://amedeo.com/lit.php?id=15163498
- Shafer
AL, Katz JB, Eernisse KA. Development and
validation of a competitive enzyme-linked
immunosorbent assay for detection of type
A influenza antibodies in avian sera. Avian
Dis. 1998; 42: 28-34. Abstract: http://amedeo.com/lit.php?id=9533078
- Shinya
K, Hamm S, Hatta M, Ito H, Ito T, Kawaoka
Y. PB2 amino acid at position 627 affects
replicative efficency but not cell tropism
of Hong Kong H5N1 influenza viruses in mice.
Virology 2004; 320: 258-266. Abstract: http://amedeo.com/lit.php?id=15016548
- Shortridge
KF, Zhou NN, Guan Y, et al. Characterization
of avian H5N1 influenza viruses from poultry
in Hong Kong. Virology. 1998 Dec 20;252(2):331-42.
Abstract: http://amedeo.com/lit.php?id=9878612
- Smith
AW, Skilling DE, Castello JD, Rogers SO.
Ice as a reservoir for pathogenic human
viruses: specifically, caliciviruses,
influenza viruses, and enteroviruses. Med
Hypotheses 2004; 63: 560-6. Abstract: http://amedeo.com/lit.php?id=15324997
- Snyder
DB, Marquardt WW, Yancey FS, Savage PK.
An enzyme-linked immunosorbent assay for
the detection of antibody against avian
influenza virus. Avian Dis 1985; 29: 136-44.
Abstract: http://amedeo.com/lit.php?id=3985870
- Spackman
E, Senne DA, Myers TJ, et al. Development
of a real-time reverse transcriptase PCR
assay for type A influenza virus and the
avian H5 and H7 hemagglutinin subtypes.
J Clin Microbiol 2002; 40: 3256-60. Abstract:
http://amedeo.com/lit.php?id=12202562
- Stallknecht
DE, Kearney MT, Shane SM, Zwank PJ. Effects
of pH, temperature, and salinity on persistence
of avian influenza viruses in water. Avian
Dis 1990b; 34: 412-8. Abstract: http://amedeo.com/lit.php?id=2142421
- Stech
J, Garn H, Wegmann M, Wagner R, Klenk HD.
A new approach to an influenza live vaccine:
modification of the cleavage site
of hemagglutinin. 2005; Nat Med 11: 683-689.
Abstract: http://amedeo.com/lit.php?id=15924146
- Suarez
DL, Senne DA, Banks J, Brown IH, Essen SC,
Lee CW, Manvell RJ, Mathieu-Benson C, Moreno
V, Pedersen JC, Panigrahy B, Rojas H, Spackman
E, Alexander DJ. Recombination resulting
in virulence shift in avian influenza outbreak,
Chile. Emerg Infect Dis 2004; 10: 693-9.
Abstract: http://amedeo.com/lit.php?id=15200862
- Full text at http://www.cdc.gov/ncidod/EID/vol10no4/03-0396.htm
-
Suzuki
Y. Sialobiology of influenza: molecular
mechanism of host range variation of influenza
viruses. Biol Pharm Bull 2005; 28: 399-408.
Abstract: http://amedeo.com/lit.php?id=15744059
- Swayne
DE, Beck JR, Kinney N. Failure of a recombinant
fowl poxvirus vaccine containing an avian
influenza hemagglutinin gene to provide
consistent protection against influenza
in chicken preimmunized with a fowl pox
vaccine. Avian Dis 2000b; 44: 132-7. Abstract:
http://amedeo.com/lit.php?id=10737653
- Swayne
DE, Beck JR, Mickle TR. Efficacy of recombinant
fowl poxvirus vaccine in protecting chicken
against a highly pathogenic Mexican-origin
H5N2 avian influenza virus. Avian Dis 1997;
41: 910-22. Abstract: http://amedeo.com/lit.php?id=9454926
- Swayne
DE, Beck JR, Perdue ML, Beard CW. Efficacy
of vaccines in chicken against highly pathogenic
Hong Kong H5N1 avian influenza. Avian Dis
2001; 45: 355-65. Abstract: http://amedeo.com/lit.php?id=11417815
- Swayne
DE, Garcia M, Beck JR, Kinney N, Suarez
DL. Protection against diverse highly pathogenic
H5 avian influenza viruses in chicken immunized
with a recombinant fowlpox vaccine containing
an H5 avian influenza hemagglutinin gene
insert. Vaccine 2000c; 18: 1088-95. Abstract:
http://amedeo.com/lit.php?id=10590330
- Swayne
DE, Suarez DL, Schultz-Cherry S, et al.
Recombinant paramyxovirus type 1-avian influenza-H7
virus as a vaccine for protection of chicken
against influenza and Newcastle disease.
Avian Dis 2003; 47: Suppl: 1047-50. Abstract:
http://amedeo.com/lit.php?id=14575108
- Taubenberger
JK, Reid AH, Lourens RM, Wang R, Jin G,
Fanning TG. Characterization of the 1918
influenza virus polymerase genes. Nature.
2005 Oct 6;437(7060):889-93. Abstract: http://amedeo.com/lit.php?id=16208372
- Tian
G, Zhang S, Li Y, Bu Z, Liu P, Zhou J, Li
C, Shi J, Yu K, Chen H. Protective efficacy
in chicken, geese and ducks of an H5N1-inactivated
vaccine developed by reverse genetics. Virology
2005; 341: 153-62. Abstract: http://amedeo.com/lit.php?id=16084554
- Tumpey
TM, Alvarez R, Swayne DE, Suarez DL. Diagnostic
approach for differentiating infected from
vaccinated poultry on the basis of antibodies
to NS1, the nonstructural protein of influenza
A virus. J Clin Microbiol 2005; 43: 676-83.
Abstract: http://amedeo.com/lit.php?id=15695663
- Veits
J, Luschow D, Kindermann K, et al. Deletion
of the non-essential UL0 gene of infectious
laryngotracheitis (ILT) virus leads to attenuation
in chicken, and UL0 mutants expressing influenza
virus hemagglutinin (H7) protect against
ILT and fowl plague. J Gen Virol 2003; 84:
3343-52. Abstract: http://amedeo.com/lit.php?id=14645915
- Wagner
R, Matrosovich M, Klenk HD. Functional balance
between haemagglutinin and neuraminidase
in influenzavirus infections. Rev Med Virol
2002; 12: 159-66. Abstract: http://amedeo.com/lit.php?id=11987141
- Walker
JA, Kawaoka Y. Importance of conserved amino
acids at the cleavage site of the haemagglutinin
of a virulent avian influenza A virus. J
Gen Virol 1993; 74: 311-4. Abstract: http://amedeo.com/lit.php?id=8429306
- Wan
H, Perez DR. Quail carry sialic acid receptors
compatible with binding of avian and human
influenza viruses. Virology. 2005 Dec 1;
[Epub ahead of print]. Abstract: http://amedeo.com/lit.php?id=16325879
- Watowich
SJ, Skehel JJ, Wiley DC. Crystal structures
of influenza virus hemagglutinin in complex
with high-affinity receptor analogs. Structure
1994; 2: 719-31. Abstract: http://amedeo.com/lit.php?id=7994572
- Webster
RG, Yakhno MA, Hinshaw VS, Bean WJ, Murti
KG. Intestinal influenza: replication and
characterization of influenza viruses in
ducks. Virology 1978; 84: 268-78. Abstract:
http://amedeo.com/lit.php?id=23604
- Webster
RG, Bean WJ, Gorman OT, Chambers TM, Kawaoka
Y. Evolution and ecology of influenza A
viruses. Microbiol Rev 1992; 56: 152-79.
Abstract: http://amedeo.com/lit.php?id=1579108
- Whittaker
G, Bui M, Helenius A. The role of nuclear
import and export in influenza virus infection.
Trends Cell Biol. 1996 Feb;6(2):67-71. Abstract:
http://amedeo.com/lit.php?id=15157497
- Wood
GW, McCauley JW, Bashiruddin JB, Alexander
DJ. Deduced amino acid sequences at the
haemagglutinin cleavage site of avian influenza
A viruses of H5 and H7 subtypes. Arch Virol
1993; 130: 209-17. Abstract: http://amedeo.com/lit.php?id=8503786
- Woolcock
PR, McFarland MD, Lai S, Chin RP. Enhanced
recovery of avian influenza virus isolates
by a combination of chicken embryo inoculation
methods. Avian Dis 2001; 45: 1030-5. Abstract:
http://amedeo.com/lit.php?id=11785874
- Xu
X, Subbarao, Cox NJ, Guo Y. Genetic characterization
of the pathogenic influenza A/Goose/Guangdong/1/96
(H5N1) virus: similarity of its hemagglutinin
gene to those of H5N1 viruses from the 1997
outbreaks in Hong Kong. Virology 1999; 261:
15-9. Abstract: http://amedeo.com/lit.php?id=10484749
- Xu
C, Fan W, Wei R, Zhao H (2004). Isolation
and identification of swine influenza recombinant
A/Swine/Shandong/1/2003 (H9N2) virus. Microbes
Infect 6: 919-25. Abstract: http://amedeo.com/lit.php?id=15310468
- Yuen
KY, Chan PK, Peiris M, et al. Clinical features
and rapid viral diagnosis of human disease
associated with avian influenza A H5N1 virus.
Lancet 1998; 351: 467-71. Abstract: http://amedeo.com/lit.php?id=9482437
- Zhou
N, He S, Zhang T, Zou W, Shu L, Sharp GB,
Webster RG. Influenza infection in humans
and pigs in southeastern China. Arch Virol.
1996;141(3-4):649-61. Abstract: http://amedeo.com/lit.php?id=8645101
- Zhou
EM, Chan M, Heckert RA, Riva J, Cantin MF.
Evaluation of a competitive ELISA for detection
of antibodies against avian influenza virus
nucleoprotein. Avian Dis 1998; 42: 517-22.
Abstract: http://amedeo.com/lit.php?id=9777152
|
|
|
|
|

